题目内容
【题目】如图所示是制取溴苯的装置。回答下列问题:
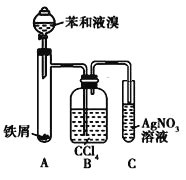
(1)装置C中观察到的现象是_____,证明_____。
(2)装置B是吸收瓶,瓶内盛有CCl4,实验中观察到的现象是_____,原因是_____;
(3)如果没有装置B,将装置A、C直接相连,则该套实验装置 _____(填“合理”或 “不合理”),原因是_____。
(4)实验完毕后,将装置A试管中的液体倒入盛有冷水的烧杯中,烧杯_____(填“下”或“上”)层为溴苯。
【答案】导管口有白雾出现,试管中有浅黄色沉淀产生 有HBr生成 B中导气管口有气泡生成,CCl4颜色由无色逐渐变为橙红色 装置A中的溴化氢、溴蒸气和苯蒸气通过导管进入到装置B中,所以导管口有气泡;装置A中的溴蒸气逸出并溶于CCl4中,所以CCl4颜色由无色逐渐变为橙红色 不合理 溴蒸气也能和AgNO3反应生成AgBr 下
【解析】
实验制备溴苯的反应原理为:2Fe+3Br2=2FeBr3, +Br2
+Br2![]()
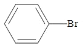 +HBr。图中,装置A为
+HBr。图中,装置A为 和Br2在FeBr3的催化下发生反应,由于反应放热,苯和液溴易挥发导致所得溴苯不纯净,装置B中CCl4的作用是除去HBr气体中的苯蒸气和溴蒸气。装置C中加入了AgNO3溶液,会与HBr发生反应:AgNO3+HBr=AgBr↓+HNO3,生成浅黄色沉淀。据此进行分析。
和Br2在FeBr3的催化下发生反应,由于反应放热,苯和液溴易挥发导致所得溴苯不纯净,装置B中CCl4的作用是除去HBr气体中的苯蒸气和溴蒸气。装置C中加入了AgNO3溶液,会与HBr发生反应:AgNO3+HBr=AgBr↓+HNO3,生成浅黄色沉淀。据此进行分析。
(1)装置C中为HBr与AgNO3反应生成AgBr,故观察到的现象是导管口有白雾出现,试管中有浅黄色沉淀产生,证明了有HBr生成。答案为:导管口有白雾出现,试管中有浅黄色沉淀产生;有HBr生成;
(2)装置A中的溴化氢、溴蒸气和苯蒸气通过导管进入到装置B中,可以看到B中导气管口有气泡生成,根据相似相溶原理,溴易溶于CCl4中,故而CCl4因为溶解了溴蒸气,其颜色由无色逐渐变为橙红色。答案为:B中导气管口有气泡生成,CCl4颜色由无色逐渐变为橙红色;装置A中的溴化氢、溴蒸气和苯蒸气通过导管进入到装置B中,所以导管口有气泡;装置A中的溴蒸气逸出并溶于CCl4中,所以CCl4颜色由无色逐渐变为橙红色;
(3)因为溴蒸气也能和AgNO3反应生成AgBr,故若是没有装置B,将装置A、C直接相连,则该套实验装置设置不合理,答案为:不合理;溴蒸气也能和AgNO3反应生成AgBr;
(4)溴苯的密度大于水的密度,且不溶于水,故将装置A试管中的液体倒入盛有冷水的烧杯中,烧杯下层为溴苯,答案为:下。