题目内容
(2011?广西模拟)短周期元素 A、B、C、D 原子序数依次增大,且只有 C 为金属元素. A、C 位于同一主族,B 的最外层电子数是次外层的 3 倍,B、C 的最外层电子数之和与 D 的最外层电子数相等. 请回答下列问题:
(1)D 的最高价氧化物对应水化物的名称为
(2)C2B2 的电子式为
 ,其中含有的化学键类型为
,其中含有的化学键类型为
(3)用石墨电极电解 CD 的饱和溶液,反应的化学方程式为
(4)实验室欲检验 CD 溶液中所含的 D-,操作方法和现象为
(1)D 的最高价氧化物对应水化物的名称为
高氯酸
高氯酸
(2)C2B2 的电子式为


离子键、非极性键
离子键、非极性键
(3)用石墨电极电解 CD 的饱和溶液,反应的化学方程式为
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
| ||
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
若反应后溶液的体积为 200mL,测得 pH 为 13,则阳极得到的气体质量为
| ||
0.71g
0.71g
,外电路中通过电子的物质的量为0.02mol
0.02mol
(4)实验室欲检验 CD 溶液中所含的 D-,操作方法和现象为
取少许试液,向其中加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,则证明有Cl-
取少许试液,向其中加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,则证明有Cl-
.分析:短周期元素 A、B、C、D 原子序数依次增大,且只有 C 为金属元素. B 的最外层电子数是次外层的 3 倍,则B有2个电子层,最外层电子数为6,故B为氧元素;且只有 C 为金属元素,原子序数大于氧元素,则C为钠或镁或铝,B、C 的最外层电子数之和与 D 的最外层电子数相等,则C的最外层电子数≤2,A、C 位于同一主族,故A、C 位于ⅠA族,故A为氢元素,C为钠元素,D为氯元素.
解答:解:短周期元素 A、B、C、D 原子序数依次增大,且只有 C 为金属元素. B 的最外层电子数是次外层的 3 倍,则B有2个电子层,最外层电子数为6,故B为氧元素;且只有 C 为金属元素,原子序数大于氧元素,则C为钠或镁或铝,B、C 的最外层电子数之和与 D 的最外层电子数相等,则C的最外层电子数≤2,A、C 位于同一主族,故A、C 位于ⅠA族,故A为氢元素,C为钠元素,D为氯元素,即A为氢元素,B为氧元素;C为钠元素,D为氯元素.
(1)D为氯元素,氯元素的最高价氧化物对应水化物是高氯酸,故答案为:高氯酸;
(2)B为氧元素;C为钠元素,C2B2 为Na2O2,由钠离子与过氧根离子构成,电子式为 ,其中钠离子与过氧根离子之间为离子键,过氧根离子中氧原子之间为非极性键,故答案为:
,其中钠离子与过氧根离子之间为离子键,过氧根离子中氧原子之间为非极性键,故答案为: ;离子键、非极性键;
;离子键、非极性键;
(3)用石墨电极电解NaCl的饱和溶液,反应的化学方程式为 2NaCl+2H2O
Cl2↑+H2↑+2NaOH;若反应后溶液的体积为 200mL,测得 pH为13,c(OH-)=0.1mol/L,所以n(NaOH)=0.2L×0.1mol/L=0.02mol,阳极发生氧化反应,阳极生成的气体为氯气,由方程式可知n(Cl2)=
n(NaOH)=0.01mol,质量为0.01mol×71g/mol=0.71g;根据电子转移守恒可知,外电路中通过电子的物质的量为0.01mol×2=0.02mol,
故答案为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH;0.71g;0.02mol;
(4)实验室欲检验NaCl溶液中所含的 Cl-,操作方法和现象为:取少许试液,向其中加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,则证明有Cl-,
故答案为:取少许试液,向其中加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,则证明有Cl-.
(1)D为氯元素,氯元素的最高价氧化物对应水化物是高氯酸,故答案为:高氯酸;
(2)B为氧元素;C为钠元素,C2B2 为Na2O2,由钠离子与过氧根离子构成,电子式为
 ,其中钠离子与过氧根离子之间为离子键,过氧根离子中氧原子之间为非极性键,故答案为:
,其中钠离子与过氧根离子之间为离子键,过氧根离子中氧原子之间为非极性键,故答案为: ;离子键、非极性键;
;离子键、非极性键;(3)用石墨电极电解NaCl的饱和溶液,反应的化学方程式为 2NaCl+2H2O
| ||
| 1 |
| 2 |
故答案为:2NaCl+2H2O
| ||
(4)实验室欲检验NaCl溶液中所含的 Cl-,操作方法和现象为:取少许试液,向其中加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,则证明有Cl-,
故答案为:取少许试液,向其中加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,则证明有Cl-.
点评:本题考查结构性质与位置关系、电子式、电解原理及计算、实验方案设计等,难度中等,推断元素是解题关键,以B元素为突破口,综合分析元素性质与原子序数、最外层电子数关系进行推断.

练习册系列答案
相关题目
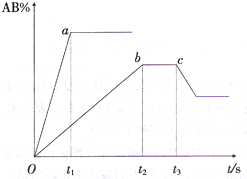 (2011?广西模拟)如图是反应 A2+B2═2AB 在不同温度和压强下,AB体积分数(AB%)的变化情况.其中a、b 曲线为相同压强、不同温度时的变化情况,c曲线是保持与b相同温度时从时间t3开始增大压强的情况下列叙述正确的是( )
(2011?广西模拟)如图是反应 A2+B2═2AB 在不同温度和压强下,AB体积分数(AB%)的变化情况.其中a、b 曲线为相同压强、不同温度时的变化情况,c曲线是保持与b相同温度时从时间t3开始增大压强的情况下列叙述正确的是( )