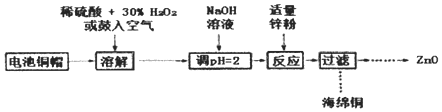
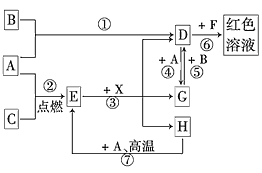
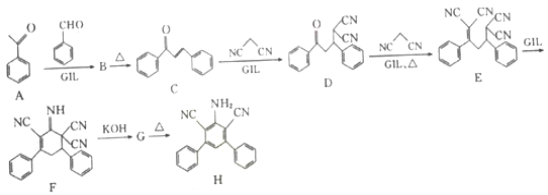
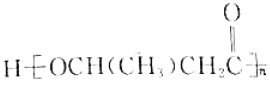题目内容
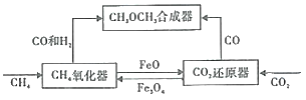
【题目】一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3) 的原理如图:
(1)二甲酸的合成反应:3CO(g)+3H2(g)=CH3OCH3(g)+CO2(g);△H1
①已知CO、CH3OCH3与H2的燃烧热(△H)分别为 a kJ/mol、b kJ/mol、c kJ/mol(a、b、c均小于0),则△H1 ____kJ/moL。
②该反应选用(CuO/ZnO/Al2O)复合催化剂,该催化剂能_____(填标号)。
A.提高反应速率 B.促进平衡正向移动 C.改变反应的焓变 D.降低反应的活化能
(2)CH4氧化器中发生的主反应:
i.CH4(g)+Fe3O4(s)=CO(g)+2H2(g)+3FeO(s)
ii.CH4(g)+4Fe3O4(s)=CO2(g)+2H2O(g)+12FeO(s)
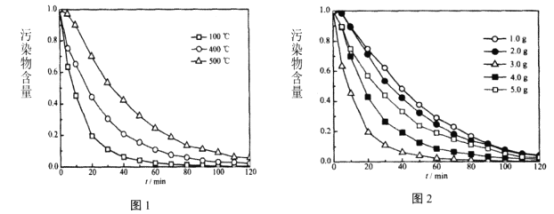
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如图。
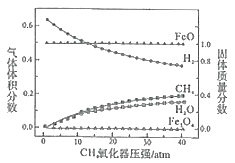
①随着压强的增大,反应i的平衡常数K值________(填“增大”、“减小”或“不变”)。
②结合图像,分析H2O的体积分数变化的原因________(用化学方程式表示)。
(3)将一定量的FeO 和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:CO2(g)+3FeO(s)=Fe3O4(s)+CO(g)。保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表。
温度t/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①△H2______0(填“>”或“<”)。
②由上表可知,若在150℃时进行上述转化,理论转化率α(FeO)为100%。在上述反应体系中,一定可以说明该反应达到平衡状态的是______(填标号)。
A.CO2的物质的量不变
B.体系的压强不变
C.气体的平均摩尔质量不变
D.CO的生成速率和消耗速率相等且不等于零
③根据化学反应原理,分析CO2还原器温度设置在170℃的原因________。
【答案】3a+3c-b AD 不变 ![]() < D 温度过高,CO2的转化率降低;温度过低,反应速率变慢
< D 温度过高,CO2的转化率降低;温度过低,反应速率变慢
【解析】
(1)①CO燃烧热的热化学方程式为CO(g)+![]() O2(g)=CO2(g);△H=a kJ·mol-1①,CH3OCH3燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l);△H=b kJ·mol-1②,H2燃烧热的热化学方程式为H2(g)+
O2(g)=CO2(g);△H=a kJ·mol-1①,CH3OCH3燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l);△H=b kJ·mol-1②,H2燃烧热的热化学方程式为H2(g)+![]() O2(g)=H2O(l);△H=c kJ·mol-1③,根据目标方程式,应是3×①+3×③-②,得出△H=(3a+3c-b)kJ·mol-1;
O2(g)=H2O(l);△H=c kJ·mol-1③,根据目标方程式,应是3×①+3×③-②,得出△H=(3a+3c-b)kJ·mol-1;
②A、使用催化剂降低活化能,提高单位体积内活化分子百分数,使反应速率加快,故A符合题意;
B、催化剂对化学平衡的移动无影响,故B不符合题意;
C、反应焓变只与始态和终态有关,催化剂不能降低反应的焓变,故C不符合题意;
D、催化剂降低反应的活化能,故D符合题意;
答案选AD;
(2)①化学平衡常数只受温度的影响,即增大压强,化学平衡常数不变;
②根据图像分析,随着反应的进行,H2的含量降低,H2O的含量增大,可推断反应过程中H2转化成H2O,发生的反应为Fe3O4和H2反应生成FeO和H2O,则化学反应方程式为![]() ;
;
(3)①根据图表分析,随着温度的升高,平衡时CO2的体积分数增大,CO的体积分数降低,标明化学平衡向逆反应方向移动,根据勒夏特列原理,正反应方向为放热反应,即△H<0;
②A、从表中可以看出温度从100℃上升到170℃,已经完全转化,此时CO2和CO的体积分数都不变,但此时不算平衡状态,因此CO2物质的量不变,不能说明反应达到平衡,故A不符合题意;
B、反应前后气体系数之和相等,即压强始终相等,因此压强不变,不能说明反应达到平衡,故B不符合题意;
C、根据A选项分析,气体平均摩尔质量不变,不能说明反应达到平衡,故C不符合题意;
D、根据化学平衡状态的定义,CO生成速率和消耗速率相等,且不等于0,说明反应达到平衡,故D符合题意;
答案选D;
③温度选择170℃,从平衡的角度分析,温度过高,CO2的转化率降低,从速率角度分析,温度过低反应速率变慢,则选择170℃。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】实验室制备溴苯的反应装置如图所示,回答下列问题:
已知:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
水中的溶解度 | 微溶 | 微溶 | 微溶 |
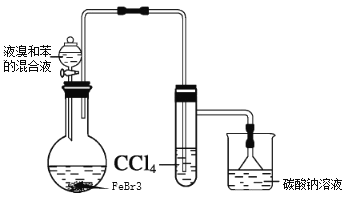
(1)实验装置c的作用为_______。
(2)写出实验室制备溴苯的反应方程式_______。
(3)本实验得到粗溴苯后,除去铁屑,再用如下操作精制:a蒸馏;b水洗;c用干燥剂干燥;d 10%NaOH溶液洗涤;e水洗,正确的操作顺序是________。
(4)本实验使用6mL无水苯、4.0mL液溴和少量铁屑,充分反应,经精制得到6.5mL的溴苯。则该实验中溴苯的产率是_______。