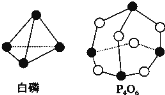
题目内容
【题目】在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g)![]() M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
A. 0~5 min,X的平均反应速率为0.08 mol·L-1·min-1
B. 0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1
C. 平衡后升高温度,X的反应速率降低
D. 到达平衡状态时,反应放出的热量为a kJ
【答案】B
【解析】
A. . 0~5 min,M的物质的量变化了0.4 mol-0 mol=0.4 mol,浓度变化为![]() =0.2mol/L,依据
=0.2mol/L,依据![]() 可知,用M表示的平均反应速率为v (M)=
可知,用M表示的平均反应速率为v (M)=![]() =0.04 mol·L-1·min-1,则v(X) =v (M)= 0.04 mol·L-1·min-1,A项错误;
=0.04 mol·L-1·min-1,则v(X) =v (M)= 0.04 mol·L-1·min-1,A项错误;
B.参加反应的物质对应的化学计量数之比等于化学反应速率之比,根据A项可知v(Y)=2v (M)= 2×0.04 mol·L-1·min-1=0.08 mol·L-1·min-1,B项正确;
C. 升高温度,不论是任何反应,反应速率都加快,因此v(正)、v(逆)均增大,则X的反应速率增大,C项错误;
D. 该反应是可逆反应,反应不会进行彻底,故1molX和2molY反应后产生的热量小于akJ,
D项错误;
答案选B。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。

[查阅资料]①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3。
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+===Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为___________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→__________________。(填字母编号)
(3)实验中滴加稀盐酸的操作为______________________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是________________;装置F的作用为_________________________________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______________________________________________。
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol·L1AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
__________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |