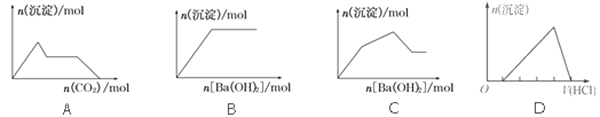题目内容
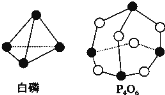
【题目】已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能:P-P:198kJ/mol,P-O:360kJ/mol,O=O:498kJ/mol,则反应P4(白磷)+3O2=P4O6的能量变化为( )
A. 放出热量1638kJB. 吸收热量1638kJ
C. 放出热量126kJD. 吸收热量126kJ
【答案】A
【解析】
反应热△H=反应物总键能-生成物总键能,据此计算判断,注意每摩尔P4中含有6molP-P键。
P-P:198kJ/mol,P-O:360kJ/mol,O=O:498kJ/mol,反应热△H=反应物总键能-生成物总键能,由图可知:1个P分子中含有6个P-P,1个P4O6分子中含有12个P-O,1mol P4和3molO2完全反应(P4+3O2=P4O6)生成1molP4O6,所以反应P4+3O2=P4O6的反应热△H=6×kJ/mol +3×498 kJ/mol -12×360 kJ/mol =-1638k kJ/mol,即该反应发生时放热1638kJ,故合理选项是A。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目