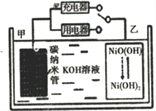
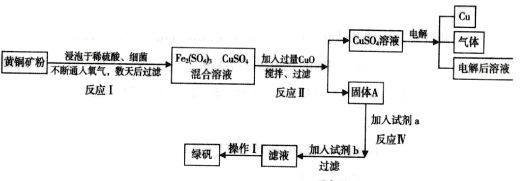
��Ŀ����
����Ŀ����ͼ��ʾ:��B����װ��100mLˮ,�ݻ�Ϊa mL���Թ�A������NO2��NO�Ļ������(��״��),���Թ�A������B�۵�ˮ��,��ַ�Ӧ,�Թ�A��������������Ϊ0.6amL��

(1)��A������Bˮ���з����ķ�ӦΪ________________________________ ,�÷�Ӧ���������뻹ԭ����������Ϊ__________ ,ԭ���������NO2��NO�����ʵ���֮��Ϊ________��
(2)ͨ��������C������������Թ�A�л�������ͨ������,A�п��ܹ۲쵽��������: __________��
(3)���Թ�A�г�������ʱֹͣͨ������,Ȼ���Թ�ȡ��ˮ��,ˮ��B����Һ�����ʵ���Ũ��Ϊ_________ (����Һ�������Ϊ100mL)��
���𰸡� 3NO2��H2O��2HNO3��NO 1:2 3��2 ��ɫ�����Ϊ����ɫ���壬�Թ���Һ�治��������ȫ����������ͨ���������Թ���Һ���½�����������ɫ���� a/2240
��������(1)������������ˮ���������NO����A������Bˮ���з����ķ�ӦΪ3NO2��H2O��2HNO3��NO���÷�Ӧ���������������NO�ǻ�ԭ���NO2����������Ҳ�ǻ�ԭ�������������뻹ԭ����������Ϊ1:2��������NO2��NO�Ļ�����壨��״�����Թ�A������ˮ�г�ַ�Ӧ���Թ�A��������������Ϊ0.6a mL������ݷ���ʽ��֪
3NO2��H2O��2HNO3��NO ������١�V
3 2
V amL-0.6amL=0.4amL
���V��0.6amL����NO���ΪamL-0.6amL=0.4amL����n��NO2����n��NO����3��2��
(2)ͨ��������C������������Թ�A�л�������ͨ��������NO��������Ӧ���ɶ���������������������ˮ�ֲ���ѧ����NO����A�п��ܹ۲쵽����������ɫ�����Ϊ����ɫ���壬�Թ���Һ�治��������ȫ����������ͨ���������Թ���Һ���½�����������ɫ���壻
(3)���ݵ�Ԫ���غ��֪��ˮ����������������ʵ���Ϊ��n��HNO3����n��NO2��+n��NO����![]() ���������Ũ��Ϊ
���������Ũ��Ϊ![]() ��
��

 �������Ͽ�ʱͬ��ѵ��ϵ�д�
�������Ͽ�ʱͬ��ѵ��ϵ�д� �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�����Ŀ���ס�����ͬѧΪ̽��SO2������Ա���ǿ�����ܷ�Ӧ���ɰ�ɫBaSO3����������ͼ��ʾװ�ý���ʵ�����г�װ�ú�A�м���װ�����ԣ��������Ѽ�������
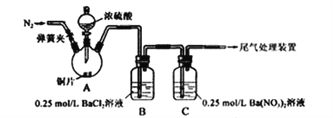
ʵ�����������
���� | ���� |
�رյ��ɼУ��μ�һ����Ũ���ᣬ���� | A���а������ɣ�ͭƬ����������� B��������ð��������������ɫ���� C�в�����ɫ������Һ���Ϸ�����dz��ɫ������ʧ |
���ɼУ�ͨ��N2��ֹͣ���ȣ�һ��ʱ���ر� | |
��B��C�зֱ�ȡ������ɫ��������ϡ���� | ��δ���ְ�ɫ�����ܽ� |
��1��A�з�Ӧ�Ļ�ѧ����ʽ��_________________��
��2��C�����ɰ�ɫ���������ӷ���ʽΪ__________________��
��3������B�в�����ϡ����ij���������ԭ����Ϊ�ǿ������뷴Ӧ������Ϊ�ǰ������뷴Ӧ��Ϊ֤ʵ���ԵĹ۵㣬��ԭʵ������ϣ��ס�����ͬѧ�ֱ���������ʵ�飺����ԭ�в���֮ǰͨN2,һ��ʱ�䣬B�в���������ɫ����������A��B������ʢ�ű���NaHSO3��Һ��ϴ��ƿ��B����������ɫ��������������������ԭ����_____________��
��4����ϣ�3������ͬѧ��ʵ����������Ϊԭʵ��B�в���������ɫ��������Ҫԭ����_____________��