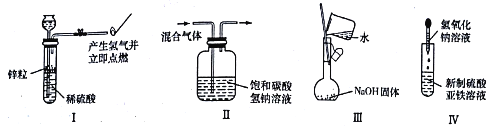
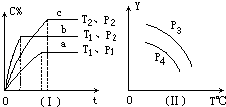题目内容
【题目】电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:①电解池中X极上的电极反应式为;在X极附近观察到的现象是 .
②Y电极上的电极反应式为;检验该电极反应产物的方法是 .
(2)如用电解方法精炼粗铜,电解液a选用CuSO4溶液,则①X电极的材料是 , 电极反应式为 .
②Y电极的材料是 , 电极反应式为 . (说明:杂质发生的电极反应不必写出)
【答案】
(1)2H++2e﹣=H2↑;放出气体,溶液变红;2Cl﹣﹣2e﹣=Cl2↑;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色
(2)纯铜;Cu2++2e﹣=Cu;粗铜;Cu﹣2e﹣=Cu2+
【解析】解:(1)①和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e﹣=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,所以答案是:2H++2e﹣=H2↑;放出气体,溶液变红;②和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl﹣﹣2e﹣=Cl2↑,氯气能使湿润的碘化钾淀粉试纸变蓝,可以用于氯气的检验,所以答案是:2Cl﹣﹣2e﹣=Cl2↑;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色;(2)①电解方法精炼粗铜,电解池的阴极材料是纯铜,电极反应为:Cu2++2e﹣=Cu,所以答案是:纯铜; Cu2++2e﹣=Cu;②电解方法精炼粗铜,电解池的阳极材料是粗铜,电极反应为:Cu﹣2e﹣=Cu2+ , 所以答案是:粗铜;Cu﹣2e﹣=Cu2+ .

【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g) +Cl2(g) ![]() COCl2(g) ;ΔH = a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ;ΔH = a kJ/mol反应过程中测定的部分数据如下表:
t/min | n(CO)/mol | n(Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应0~2min末的平均速率v(COCl2)=______mol/(L·min)。
②在2min~4min间,v正(Cl2) _________v逆(CO) (填“>”、“=”或“<”), 该温度下K = _____。
③ 已知X、L可分别代表温度或压强,下图表示L一定时,CO的 转化率随X的变化关系。

X代表的物理量是 __________;a_____ 0 (填“>”,“=”,“<”)。
(2)在催化剂作用下NO和CO转化为无毒气体: 2CO(g)+2NO(g) ![]() 2CO2(g)+N2 (g) ;ΔH=-748 kJ·mol-1
2CO2(g)+N2 (g) ;ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是 ________________ 。

②已知:测定空气中NO和CO 含量常用的方法有两种:方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为________________。方法2:氧化还原滴定法。用H2O2溶液吸收尾气、将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸依度。写出NO 与H2O2溶液反应的离子方程式:________________________________。
(3)NO2 会污染环境,可用Na2CO3 溶液吸收NO2 并生成CO2,已知9.2g NO2气体和Na2CO3 溶液完全反应时转移电子0.1mol,恰好反应后,使得溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中存在的所有离子浓度大小关系是_____________________。
【题目】下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
A | 盐酸 | 醋酸 | 碳酸 | 氨水 | 氯水 |
B | 纯碱 | 碘酒 | 苛性钾 | 冰醋酸 | 干冰 |
C | 石油 | 石灰石 | 硫酸 | 磷酸 | 水 |
D | 烧碱 | 天然气 | 氯化钠 | 碳酸钠 | 蔗糖 |
A. A B. B C. C D. D