题目内容
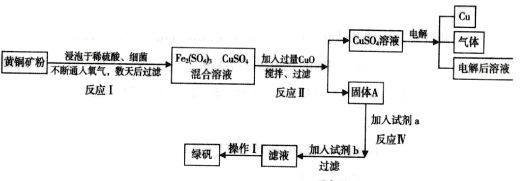
【题目】以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐,某工厂运用该原理生产铜和绿矾(FeSO4的晶体,含结晶水)。
回答下列问题:
(1)写出反应Ⅰ的化学反应方程式:__________________________;
(2)反应II中CuO的作用是_________________________;
(3)写出加入试剂b发生的反应离子方程式_________________________________________;
(4)欲从溶液中获得绿矾晶体,分离操作I应为___________________________;
(5)生产过程中,可循环使用的物质有__________________(写化学式)。
【答案】 4CuFeS2+2H2SO4+17O2=2Fe2(SO4)3+4CuSO4+2H2O 调节溶液的pH使Fe3+转化为Fe(OH)3沉降除去 Fe+Cu2+=Fe2++Cu Fe+2Fe3+=3Fe2+ 蒸发浓缩,降温结晶,过滤 O2 H2SO4
【解析】运用湿法炼铜的同时制绿矾(FeSO47H2O)的工艺:将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)浸泡于稀硫酸细菌,通入氧气,数天后过滤,得到氧化成含Fe3+,Cu2+的溶液,加入过量CuO,促进铁离子水解生成氢氧化铁沉淀与铜离子分离,过滤得到固体A为氢氧化铁和过量的氧化铜,溶液为硫酸铜溶液,硫酸铜溶液电解生成铜、氧气和硫酸;氢氧化铁中加入试剂a为稀硫酸,用稀硫酸溶解,再用试剂b为铁粉还原可得滤液为硫酸亚铁溶液,再通过蒸发浓缩、隔绝降温结晶、过滤、洗涤、干燥得绿矾。
(1)反应Ⅰ中的反应物是CuFeS2、O2、H2SO4三种物质,生成物是硫酸铁、硫酸铜和水,根据奇偶法配平,所以方程式是:4CuFeS2+17O2+2H2SO4═2Fe2(SO4)3+4CuSO4+2H2O;故答案为: 4CuFeS2+17O2+2H2SO4═2Fe2(SO4)3+4CuSO4+2H2O;
(2)加入过量氧化铜调节溶液pH,使铁离子变成氢氧化铁沉淀,故答案为:调节混合溶液的pH,使Fe3+转化为Fe(OH)3沉降除去;
(3)试剂b为铁粉,发生反应的离子方程式为Fe+Cu2+=Fe2++Cu、Fe+2Fe3+=3Fe2+,故答案为:Fe+Cu2+=Fe2++Cu、Fe+2Fe3+=3Fe2+;
(4)获得的滤液经过蒸发浓缩、冷却结晶、过滤,最后得到绿矾,故答案为:蒸发浓缩,冷却结晶,过滤;
(5)根据流程图,可循环使用的物质有O2、H2SO4,故答案为:O2、H2SO4。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案