题目内容
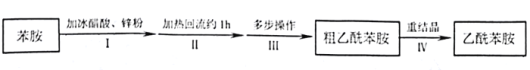
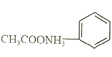
【题目】乙酰苯胺是用途广泛的化工原料,主要应用于医药、日用化工等诸多领域。某兴趣小组制备流程如下:
已知:
a.乙酰苯胺在水中的溶解度随温度的升高而增大
b.苯胺在空气中受热易被氧化
c.
名称 | 苯胺 | 醋酸 | 乙酰苯胺 |
沸点 | 184.4 | 117.9 | 304 |
d.反应原理:![]() +CH3COOH
+CH3COOH ![]()
![]() +H2O
+H2O
请回答:
(1)步骤Ⅰ,加入锌粉的目的__________。
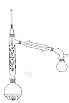
(2)步骤Ⅱ实验装置如图(加热装置省略),具体实验过程:装上一刺形分馏柱,插上温度计。用酒精灯加热,使反应溶液在微沸状态下回流,调节加热温度,使柱顶温度105℃左右,反应约![]() 。在反应瓶上装一个刺形分馏柱,其作用是__________。
。在反应瓶上装一个刺形分馏柱,其作用是__________。
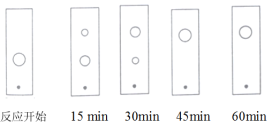
(3)步骤Ⅱ某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流![]() 、
、![]() 、
、![]() 和
和![]() 时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是______。
时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是______。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(4)步骤Ⅳ,关于重结晶的操作,下列说法正确的是________。
A.选蒸馏水作为重结晶提纯乙酰苯胺的溶剂
B.粗制的有机化合物中常常含有有色杂质,可用活性炭进行脱色
C.趁热过滤时,需将菊花形滤纸放入长颈玻璃漏斗,一并放入保温漏斗中
D.趁热过滤也可以用减压过滤代替,提前将布氏漏斗放在沸腾的水浴中加热,防止乙酰苯胺热溶液遇到冷的布氏漏斗而提前析出。
E.冷却结晶时一般是在室温下自然冷却。当溶液降至室温,析出大量乙酰苯胺晶体后,可用冰水进一步冷却,以便晶体析出更加彻底。
(5)物质制备时,通常对纯度有一定要求,从结构与性质角度分析,上述制备过程中“由非氧化还原反应”产生的杂质可能有__________、_________。
【答案】防止苯胺被氧化 使水和醋酸的混合气体在分馏柱内进行多次汽化和冷凝,使这两种气体得到分离,从而减少醋酸蒸出,保证水的顺利蒸出 C ABDE 
【解析】
利用苯胺与冰醋酸混合加热制取乙酰苯胺时,需使用冷凝管进行冷凝回流,以防苯胺和乙酸挥发,同时需加入锌粉,防止苯胺被空气中的氧气氧化,为提高苯胺的转化率,可加入过量的冰醋酸;为了有效控制加热时间,需在实验过程中跟踪反应进程,当发现反应物基本转化为产物时,停止加热回流;反应结束后,应将反应液趁热倒入冷水中,此时乙酰苯胺结晶析出,乙酸和苯胺溶解在水中;为提纯粗产品,可进行重结晶。重结晶时,将粗产品溶于热水,可用活性炭脱去有色物质,趁热过滤以滤去不溶性杂质,然后将滤液降温,让乙酰苯胺结晶析出,再过滤、用冷水洗涤,干燥。
(1)苯胺具有较强的还原性,易被空气中的氧气氧化,步骤Ⅰ,加入锌粉的目的:防止苯胺被氧化。答案为:防止苯胺被氧化;
(2) 105℃左右比水的沸点稍高,显然是让反应生成的水沸腾,蒸出反应生成的水,有利于平衡正向移动,从而提高反应物的转化率。在反应瓶上装一个刺形分馏柱,其作用是使水和醋酸的混合气体在分馏柱内进行多次汽化和冷凝,使这两种气体得到分离,从而减少醋酸蒸出,保证水的顺利蒸出。答案为:使水和醋酸的混合气体在分馏柱内进行多次汽化和冷凝,使这两种气体得到分离,从而减少醋酸蒸出,保证水的顺利蒸出;
(3)对照图中斑点分析,可以看出,反应开始时图上斑点为反应物,由此可推测,回流15min、30min时的图上,下面的斑点为反应物,上面的斑点为生成物,45min时图上的斑点为生成物,而反应物基本上无剩余。因此,该实验条件下比较合适的回流时间是45min。答案为:C;
(4)A.因为乙酰苯胺在水中的溶解度随温度的升高而增大,所以可选蒸馏水作为重结晶提纯乙酰苯胺的溶剂,A正确;
B.粗制有机物中先溶于热水,采用热过滤,去除不溶性杂质,再加活性炭进行脱色,然后再热过滤,B正确;
C.趁热过滤时,应先将长颈玻璃漏斗放入保温漏斗中,再将菊花形滤纸放入,并用热溶液润湿让其附着在漏斗内壁上,C不正确;
D.趁热过滤也可以用减压过滤代替,提前将布氏漏斗放在沸腾的水浴中加热,然后放入比内径稍小的滤纸,D正确;
E.冷却结晶时一般先自然冷却至室温,析出大量晶体后,用冰水再冷却,E正确;
故选ABDE。答案为:ABDE;
(5)上述制备过程中,苯胺中氮基上的两个H原子都可被乙酰基取代,另外,苯胺中的氨基也能与醋酸发生反应而生成盐,则“由非氧化还原反应”产生的杂质可能有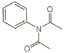 、
、![]() 。答案为:
。答案为: ;
;![]() 。
。

【题目】化学反应![]() 在四个不同条件下进行。B、D起始为0,反应物A的浓度
在四个不同条件下进行。B、D起始为0,反应物A的浓度![]() 随反应时间
随反应时间![]() 变化情况如下表:
变化情况如下表:
实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.8 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ |
| 0.8 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
3 | 800℃ |
| 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
下列说法不正确的是( )
A.实验1,反应在10至![]() 内
内![]()
B.实验2,A的初始浓度![]() ,还隐含的条件是加入了催化剂
,还隐含的条件是加入了催化剂
C.实验3的反应速率v3<实验1的反应速率v1
D.比较实验4和实验1,可推测该反应为吸热反应
【题目】(I)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究温度对反应速率的影响; (Ⅲ)实验①和④探究e_______对反应速率的影响 |
② | 25 | 粗颗粒 | a______ | |
③ | b_______ | 粗颗粒 | 2.00 | |
④ | c________ | 细颗粒 | d______ |
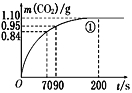
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在0~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。
(II)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验编号 | 0.1 | 0.6mol·L-1H2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
① | 10 | V1 | 35 | 25 | |
② | 10 | 10 | 30 | 25 | |
③ | 10 | 10 | V2 | 50 |
(3)表中V1=_______mL,V2=_______mL。
(4)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(5)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。