题目内容
(12分)根据下列某些短周期元素中元素性质的有关信息,回答下列问题:
(1)元素①②⑧的第一电离能由大到小的顺序是 ;元素③⑥⑨的电负性由大到小的顺序是 (以上均用元素符号填空)。
(2)元素⑤⑥⑦中的某两种形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有 (写化学式)。
(3)某元素R 的原子半径为1.02×10-10m,它与钠形成Na2R2,若物质Na2R2是一种含有非极性共价键的离子化合物,其电子式是 (R用元素符号表示)。
(4)元素①和⑨形成阳离子,其结构式为 ,其中心原子以 杂化轨道成键。
(5)元素⑤的原子基态电子排布式为 。
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 /10-10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | | +3 | +4 | +5 | +7 | +1 | +5 | |
| 最低价态 | -1 | | -2 | | -4 | -3 | -1 | | -3 | -1 |
(2)元素⑤⑥⑦中的某两种形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质有 (写化学式)。
(3)某元素R 的原子半径为1.02×10-10m,它与钠形成Na2R2,若物质Na2R2是一种含有非极性共价键的离子化合物,其电子式是 (R用元素符号表示)。
(4)元素①和⑨形成阳离子,其结构式为 ,其中心原子以 杂化轨道成键。
(5)元素⑤的原子基态电子排布式为 。
(1) H、Li、Na ;O、N、P ,(2) CCl4、PCl3
(3)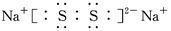 (4)
(4) sp3 (5) 1s22s22p2
sp3 (5) 1s22s22p2
(3)
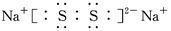 (4)
(4) sp3 (5) 1s22s22p2
sp3 (5) 1s22s22p2 (1)元素①②⑧分别是H、Na、Li。同主族自上而下金属性逐渐增强,所以第一电离能由大到小的顺序是 H、Li、Na。元素③⑥⑨O、P、N,由于非金属性越强,电负性越大,所以电负性由大到小的顺序是O、N、P。
(2)元素⑤⑥⑦分别是C、P、Cl,由于只要分子中元素化合价的绝对值和该元素绝对值的之和满足8,即能使每个原子都满足最外层为8电子稳定结构,所以符合条件的是 CCl4、PCl3。
(3)与钠形成Na2R2,则R的化合价是-1价。又因为R 的原子半径为1.02×10-10m,所以原子半径及化合价可知,R是硫元素,因此电子式为 。
。
(4)①⑨形成的是NH4+,所以结构式为 ,其结构是正四面体,所以氮原子是sp3杂化。
,其结构是正四面体,所以氮原子是sp3杂化。
(5)元素⑤是碳,根据构造原理可知,碳原子的基态电子排布式为1s22s22p2。
(2)元素⑤⑥⑦分别是C、P、Cl,由于只要分子中元素化合价的绝对值和该元素绝对值的之和满足8,即能使每个原子都满足最外层为8电子稳定结构,所以符合条件的是 CCl4、PCl3。
(3)与钠形成Na2R2,则R的化合价是-1价。又因为R 的原子半径为1.02×10-10m,所以原子半径及化合价可知,R是硫元素,因此电子式为
 。
。(4)①⑨形成的是NH4+,所以结构式为
 ,其结构是正四面体,所以氮原子是sp3杂化。
,其结构是正四面体,所以氮原子是sp3杂化。(5)元素⑤是碳,根据构造原理可知,碳原子的基态电子排布式为1s22s22p2。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

