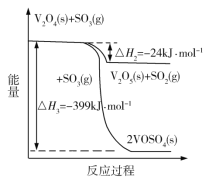
题目内容
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
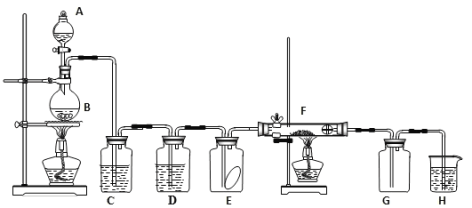
(1)装置C中盛装的溶液是____________,D中试剂的作用是____________________。
(2)E中的红色布条是否褪色?____(填“是”或“否”),写出F中反应的化学反应方程式:____________________,其反应现象为__________________________。
(3)H中的试剂为___________,用来吸收多余氯气。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,该反应的化学方程式为_________________________。
(4)8.7gMnO2固体与足量浓盐酸充分反应,在标准状况下产生Cl2的体积为_____L;其中被氧化的HCl的物质的量为_______mol。
【答案】饱和食盐水 干燥气体 否 Cu+Cl2![]() CuCl2 出现棕黄色的烟 NaOH溶液 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2.24 0.2
CuCl2 出现棕黄色的烟 NaOH溶液 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2.24 0.2
【解析】
实验室制用二氧化锰和浓盐酸共热取氯气,浓盐酸具有挥发性,则需要除去氯化氢和水蒸气,装置C为饱和食盐水,为除去HCl杂质;装置D为浓硫酸,除去水蒸气;装置E为验证干燥的氯气无漂白性;装置F为验证铜与氯气反应;H为吸收未反应的氯气。
(1)装置C为除HCl气体的装置,盛装饱和食盐水;装置D为干燥装置,除去氯气中的水蒸气;
(2)E中为干燥的红色布条,且通入干燥的氯气,则红色布条不褪色;F中为铜与氯气反应生成氯化铜,方程式为Cu+Cl2![]() CuCl2,硬质双通玻璃管中出现棕黄色的烟;
CuCl2,硬质双通玻璃管中出现棕黄色的烟;
(3)H为吸收未反应的氯气,试剂为NaOH溶液;工业上用石灰乳与氯气反应生成氯化钙、次氯酸钙和水,方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(4)8.7gMnO2,即0.1mol,根据MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,生成氯气的物质的量为0.1mol,即标况下的2.24L;其中被氧化的即化合价降低的HCl的物质的量为0.2mol。
MnCl2+Cl2↑+2H2O,生成氯气的物质的量为0.1mol,即标况下的2.24L;其中被氧化的即化合价降低的HCl的物质的量为0.2mol。