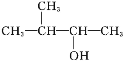
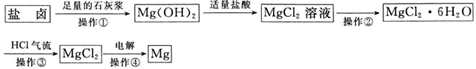
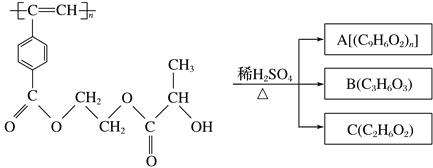
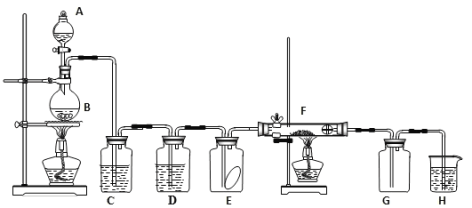
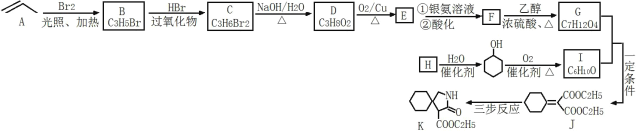
题目内容
【题目】一种高性能的碱性硼化钒(VB2)—空气电池如下图所示,其中在VB2电极发生反应:![]() 该电池工作时,下列说法错误的是
该电池工作时,下列说法错误的是

A.负载通过0.04 mol电子时,有0.224 L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为![]()
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
【答案】B
【解析】
根据图示的电池结构,左侧VB2发生失电子的反应生成![]() 和
和![]() ,反应的电极方程式如题干所示,右侧空气中的氧气发生得电子的反应生成OH-,反应的电极方程式为O2+4e-+2H2O=4OH-,电池的总反应方程式为4VB2+11O2+20OH-+6H2O=8
,反应的电极方程式如题干所示,右侧空气中的氧气发生得电子的反应生成OH-,反应的电极方程式为O2+4e-+2H2O=4OH-,电池的总反应方程式为4VB2+11O2+20OH-+6H2O=8![]() +4
+4![]() ,据此分析。
,据此分析。
A.当负极通过0.04mol电子时,正极也通过0.04mol电子,根据正极的电极方程式,通过0.04mol电子消耗0.01mol氧气,在标况下为0.224L,A正确;
B.反应过程中正极生成大量的OH-使正极区pH升高,负极消耗OH-使负极区OH-浓度减小pH降低,B错误;
C.根据分析,电池的总反应为4VB2+11O2+20OH-+6H2O=8![]() +4
+4![]() ,C正确;
,C正确;
D.电池中,电子由VB2电极经负载流向复合碳电极,电流流向与电子流向相反,则电流流向为复合碳电极→负载→VB2电极→KOH溶液→复合碳电极,D正确;
故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目