题目内容
18. 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g+2H2O (l)△H=-704 kJ•mol-1.
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)═2HCl (g)△H=-185kJ/mol
E(H-H)=436kJ/mol E(Cl-Cl)=243kJ/mol
则E(H-Cl)=432 kJ/mol
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-169kJ•mol-1,
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1,
2Cu(s)+O2(g)═2CuO(s)△H=-314kJ•mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为C(s)+2CuO(s)=Cu2O(s)+CO(g) )H=+34.5 KJ/mol.
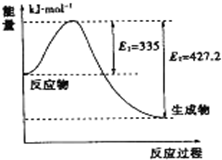
(4)①如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为:46.1 kJ.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为18.44;若在同体积的容器中充入2mol N2和6mol H2,达平衡后放出的热量为Q2 kJ,则Q2> 2Q1(填“>”、“<”或“=”)
分析 (1)16g的甲醇即0.5mol完全燃烧生成CO2和液态水时放出352kJ的热量,则1mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出704kJ的热量;
(2)根据反应热=反应物的键能-生成物的键能来分析;
(3)依据盖斯定律将已知的热化学方程式变形计算得到所需热化学方程式;
(4)①化学反应中,化学键断裂吸收能量,形成新化学键放出能量,反应热=吸收的总能量-放出的总能量,据此计算出生成1mol氨气的反应热;
②依据化学平衡计算生成氨气物质的量,结合热化学方程式计算Q1,若在同体积的容器中充入2mol N2和6mol H2,可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行计算分析达平衡后放出的热量为Q2 kJ.
解答 解:(1)16g的甲醇即0.5mol完全燃烧生成CO2和液态水时放出352kJ的热量,则1mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出704kJ的热量,热化学反应方程式为:CH3OH (l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O (l)△H=-704 kJ•mol-1,
故答案为:CH3OH (l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O (l)△H=-704 kJ•mol-1;
(2)由于反应热=反应物的键能-生成物的键能,设E(H-Cl)为Xmol,故有:E(H-H)+E(Cl-Cl)-2X=-185kJ/mol,即436kJ/mol+243kJ/mol-2X=-185KJ/mol
解得X=432KJ/mol,
故答案为:432KJ/mol;
(3)①2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-169kJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1,
③2Cu(s)+O2(g)═2CuO(s)△H=-314kJ•mol-1
依据盖斯定律②+①-③得到C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ•mol.-1;
故答案为:C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ•mol-1;
(4)①该反应的焓变△H=E1-E2=335KJ/mol-427.2KJ/mol=-92.2KJ/mol,所以每生成1molNH3放出热量为46.1kJ,
故答案为:46.1kJ;
②如图是N2和H2反应生成2mol NH3过程中能量变化示意图,反应焓变△H=335KJ/mol-427.2KJ/mol=-92.2KJ/mol,
N2(g)+3H2(g)=2NH3(g)△H=-92.2KJ/mol
1 3 0
0.2 0.6 0.4
生成0.4mol氨气放热=$\frac{0.4mol}{2mol}$×92,2KJ=18.44KJ;
若在同体积的容器中充入2mol N2和6mol H2,可以看作在原来平衡中加入1mol氮气和3mol氢气,相当于增大压强,平衡正向进行达平衡后放出的热量Q2 大于2Q1;
故答案为:18.44;>.
点评 本题考查了热化学方程式和盖斯定律的计算应用,反应键能计算费用焓变,图象分析理解,注意反应焓变的意义理解,掌握基础是关键,题目难度中等.

| A. | 胃舒平(中和过多胃酸) | B. | 阿司匹林(消炎杀菌) | ||
| C. | 青霉素(解热镇痛) | D. | 环丙沙星(抑制胃酸分泌) |
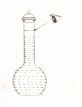 实验室某浓硫酸试剂瓶上的标签如表所示,试根据标签上的有关数据回答下列问题:
实验室某浓硫酸试剂瓶上的标签如表所示,试根据标签上的有关数据回答下列问题:| 硫酸 化学式 H2SO4 相对分子质量98 密度 1.84g/cm3 质量分数98% |
(2)某同学欲配制500mL物质的量浓度为0.30mol•L-1的稀硫酸,经计算需要8.15mL上述浓硫酸,则在实验操作中该同学需要量取8.2mL浓硫酸进行配制.若实验仪器有:A.100mL量筒;B.托盘天平;C.玻璃棒;D.50mL容量瓶;E.10mL量筒;F.胶头滴管;G.烧杯;H.500mL容量瓶.实验时应选用仪器按操作的先后顺序是E→G→C→H→A→F→(填字母).
(3)下列情况会使所配溶液浓度偏高的是AD
A.浓硫酸稀释后未冷却即转移
B.容量瓶使用前内壁沾有水珠
C.加蒸馏水时,不慎超过了刻度线
D.某同学观察液面的情况如图所示
(4)在容量瓶的使用方法中,下列操作不正确的是BC(填字母).
A.使用容量瓶前检查他是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1-2cm处,改用胶头滴管滴加蒸馏水至液面与刻度线相切
D.在容量瓶中转移溶液时应用玻璃棒引流.
| A. | 1mol N2中含有的电子数为2NA | |
| B. | 标准状态下,1mol水所含的氧原子数为1NA | |
| C. | 常温常压下,17g氨气所含的分子数大于NA | |
| D. | 2g氢气所含的氢原子数为NA |
| A. | 使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高 | |
| B. | 78 gNa2O2溶于1 L水配成溶液,可得到1 mol•L-1 NaOH溶液 | |
| C. | 标准状况下22.4LH2O所含分子数为NA | |
| D. | 100mL0.2mol•L-1的FeCl3溶液中,含Fe3+数为0.02NA |
| A. | 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O | |
| C. | 用小苏打治疗胃酸过多:CO32-+H+=CO2↑+H2O | |
| D. | 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| A. | H+H→H-H | |
| B. | Mg+2HCl═MgCl2+H2↑ | |
| C. | 2Al+Fe2O3=Al2O3+2Fe | |
| D. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O |
 ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.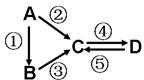 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系: