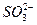题目内容
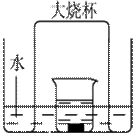
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应。小组同学改进了右图所示的装置进行实验(已知制取SO2的反应为H2SO4+Na2SO3=Na2SO4+SO2↑+H2O)。充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃。试回答下列问题:

(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,
理由_____________________________;
②措施:_________________________________,
理由______________________________________。
(2)某同学推断该白色固体为Na2SO3,则其所类比的化学反应是_____________________(用化学方程式表示)。任何的推论都要经过检验,请完成对白色固体的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、试管夹;3 mol·L-1HCl、6 mol·L-1HNO3、NaOH稀溶液、蒸馏水、1 mol·L-1 BaCl2溶液。
① 提出合理假设:
假设1: ;假设2: ;
假设3: ;
② 设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象与结论。

(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,
理由_____________________________;
②措施:_________________________________,
理由______________________________________。
(2)某同学推断该白色固体为Na2SO3,则其所类比的化学反应是_____________________(用化学方程式表示)。任何的推论都要经过检验,请完成对白色固体的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、试管夹;3 mol·L-1HCl、6 mol·L-1HNO3、NaOH稀溶液、蒸馏水、1 mol·L-1 BaCl2溶液。
① 提出合理假设:
假设1: ;假设2: ;
假设3: ;
② 设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 | 预期现象与结论 |
| 步骤1: | |
| 步骤2: | |
| … | |
(1)①产生二氧化硫没有干燥,水蒸气会与Na2O2反应;②在B、C之间加一个装有NaOH溶液的洗气瓶 除去SO2气体
(2) 2Na2O2+2CO2=2Na2CO3+O2↑
①提出合理假设
假设1:白色固体为Na2SO3 假设2:白色固体为Na2SO3与Na2SO4的混合物
假设3:白色固体为Na2SO4
②
(2) 2Na2O2+2CO2=2Na2CO3+O2↑
①提出合理假设
假设1:白色固体为Na2SO3 假设2:白色固体为Na2SO3与Na2SO4的混合物
假设3:白色固体为Na2SO4
②
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量白色固体于试管,加入足量的稀盐酸 | 若闻到刺激性气味,说明白色固体含有Na2SO3. |
| 步骤2:在步骤1的溶液加入足量的氯化钡溶液 | 若有白色沉淀生成,则说明白色固体含Na2SO4. 若步骤1现象明显,而步骤2没明显现象,则说明白色固体为Na2SO3;若步骤1现象不明显,步骤2现象明显,则说明白色固体为Na2SO4;若上述两个实验现象均有,则说明白色固体既含有Na2SO3,又含有Na2SO4。 |
本题考查过氧化钠与二氧化硫反应的探究实验。(1)干燥二氧化硫,防止水蒸气与过氧化钠,B和C直接还需要一个尾气吸收装置,除去多余的二氧化硫;(2)将SO2与CO2作比较,因为存在反应2Na2O2+2CO2=2Na2CO3+O2,类推得到方程式为:2Na2O2+2SO2=2Na2SO3+O2。但是考虑到SO2与CO2在性质上的不同,SO2中的硫元素不是最高价,能够被过氧化钠氧化,进而发生反应Na2O2+SO2=Na2SO4。综合考虑该白色而固体应该有三种可能,即白色固体为Na2SO3、白色固体为Na2SO3与Na2SO4的混合物、白色固体为Na2SO4。关于产物的验证实际上为SO42-和SO32-的检验。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
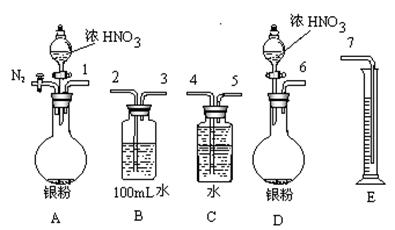
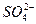 、Ag+中的一种或几种
、Ag+中的一种或几种