题目内容
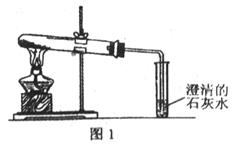
(14分)某课外活动小组设计了以下实验方案探究Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
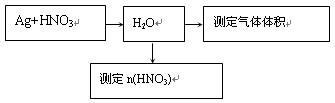
(1)测定NO的体积:
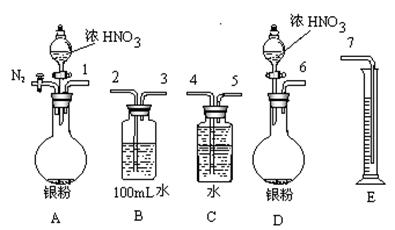
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
3→ (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
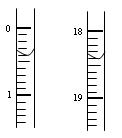
(2)测定硝酸的物质的量:反应结束后,从上图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,第一次滴定前后的滴定管中液面的位置如右图所示。请将读数填到表格的相应位置:
依据表格的数据计算出在B容器中生成硝酸的物质的量为 mol。
(3)气体成份分析:
若实验测得NO的体积为93.0mL(已折算到标准状况),则Ag与浓硝酸反应过程中
(填“有”或“没有”)NO产生,作此判断的依据是 。

(1)测定NO的体积:

①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
3→ (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(2)测定硝酸的物质的量:反应结束后,从上图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,第一次滴定前后的滴定管中液面的位置如右图所示。请将读数填到表格的相应位置:

| | 滴定前读读数/mL | 滴定后读数/mL |
| 第一次 | | |
| 第二次 | 0.10 | 18.00 |
| 第三次 | 0.20 | 18.30 |
(3)气体成份分析:
若实验测得NO的体积为93.0mL(已折算到标准状况),则Ag与浓硝酸反应过程中
(填“有”或“没有”)NO产生,作此判断的依据是 。
(1)① A(2分)② 5—4→7 (2分,有错误即零分)③升高(2分)
(2)0.40(1分) 18.40(1分) 7.2×10-3(3分)
(3)有(1分) 由3NO2 + H2O = 2HNO3 + NO生成7.2×10-3 mol HNO3同时生成3.6×10-3 mol NO,标准状况下体积为80.64mL,小于实验测得的93.0mL,所以Ag与浓硝酸反应的过程中生NO。(2分,“80.64mL”1分,表述出“80.64mL< 93.0mL” 1分)
(2)0.40(1分) 18.40(1分) 7.2×10-3(3分)
(3)有(1分) 由3NO2 + H2O = 2HNO3 + NO生成7.2×10-3 mol HNO3同时生成3.6×10-3 mol NO,标准状况下体积为80.64mL,小于实验测得的93.0mL,所以Ag与浓硝酸反应的过程中生NO。(2分,“80.64mL”1分,表述出“80.64mL< 93.0mL” 1分)
略

练习册系列答案
相关题目





 。
。 的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式: mol/L(
的NaOH溶液刚好使溶液中Cu2+全部沉淀。据此,他能求出余酸的物质的量浓度吗?若能,请写出余酸物质的量浓度的表达式: mol/L( 用含a的代数式表达,若不能,该空不填)。
用含a的代数式表达,若不能,该空不填)。

