题目内容
某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开始时产生极少量的气泡,但溴水的颜色逐渐褪去;③将镁粉放入液溴中,未观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红棕色很快褪去。
则下列关于镁与溴水的反应机理的叙述中正确的是( )
- A.镁粉只能直接与溴水中的溴反应
- B.水是镁粉与溴发生反应的催化剂
- C.产生极少量的气泡是由镁粉与水反应得到的
- D.镁粉与溴水中的酸发生反应,导致平衡移动使溴水褪色
B
试题分析:本题是一道探究性实验题。由①把镁放入冷水中,未见任何现象,说明镁与冷水不反应,溴水中存在少量Br-,镁粉放入溴水中有气体生成,但溴水的颜色褪去,所以Mg与溴反应导致溴水的颜色逐渐褪去;③④比较可知镁粉在水的催化下与溴发生反应,速率较快,所以B项正确,答案选B。
考点:考查镁与溴水反应机理的实验探究
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生实验设计能力的培养和训练。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
试题分析:本题是一道探究性实验题。由①把镁放入冷水中,未见任何现象,说明镁与冷水不反应,溴水中存在少量Br-,镁粉放入溴水中有气体生成,但溴水的颜色褪去,所以Mg与溴反应导致溴水的颜色逐渐褪去;③④比较可知镁粉在水的催化下与溴发生反应,速率较快,所以B项正确,答案选B。
考点:考查镁与溴水反应机理的实验探究
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生实验设计能力的培养和训练。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
某研究性学习小组为了探索镁粉与FeCl3溶液的反应机理,做了如下两组实验:
①将镁粉投入冷水中,未见明显现象;
②将镁粉投入FeCl3溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀.
则下列有关镁与FeCl3溶液反应的叙述中,正确的是( )
①将镁粉投入冷水中,未见明显现象;
②将镁粉投入FeCl3溶液中,观察到有气泡产生,溶液颜色逐渐变浅,同时逐渐产生红褐色沉淀.
则下列有关镁与FeCl3溶液反应的叙述中,正确的是( )
| A、镁只与FeCl3溶液中的Fe3+直接反应 | B、气泡是镁与FeCl3溶液中的水直接反应产生的 | C、红褐色沉淀是镁与水反应生成的Mg(OH)2与Fe3+反应所得 | D、汽泡是镁与FeCl3水解生成的盐酸反应产生的 |

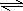 Cu(OH)2+2H+
Cu(OH)2+2H+ “白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案:
“白铁皮”具有较强的耐腐蚀性,是生产中常用的金属材料之一.镀锌层犹如铁皮的保护层,这层膜的厚度及均匀度也成了判断镀层质量的重要指标.某研究性学习小组为了测定镀锌铁皮的厚度,设计了下面的实验方案: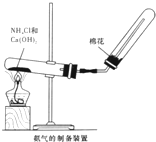 某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.
某研究性学习小组为了制取氨气和探究氨气的有关性质,进行了下列实验.