题目内容
【题目】一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:

(1)O点导电能力为零的原因是_______________________________。
(2)a、b、c三点中,CH3COOH的电离度最大的是________;a、b、c三点的pH由小到大的顺序是___________CH3COOH的电离平衡常数表达式Ka=________。
(3)若使c点溶液中c(CH3COO-)增大,则下列措施中,可选择________(填字母序号)。
A.加热 B.加入很稀的NaOH溶液
C.加入固体KOH D.加水
E.加入固体CH3COONa F.加入锌粒
(4)在CH3COOH溶液的稀释过程中,始终保持增大趋势的是________(填字母序号)。
A.c(H+) B.H+的个数
C.CH3COOH的分子数 D.c(H+)/c(CH3COOH)
(5)下列有关CH3COOH溶液的说法正确的是________(填字母序号)。
A.CH3COOH溶液中各离子浓度的关系为c(H+)=c(OH-)+c(CH3COO-)
B.向0.10 mol/L的CH3COOH溶液中加水,c(H+)增大
C.CH3COOH溶液中各离子浓度的关系为c(CH3COO-)>c(H+)>c(OH-)
D.常温下,c(H+)=0.01 mol/L的CH3COOH溶液与c(OH-)=0.01 mol/L的NaOH溶液等体积混合后,溶液呈碱性
【答案】 无水醋酸不能电离成离子 c b<a<c或b、a、c Ka=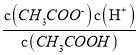 ACEF BD A
ACEF BD A
【解析】(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,所以冰醋酸不导电,故答案为:因为冰醋酸未电离,无自由移动的离子;
(2)溶液越稀,醋酸的电离程度越大,根据图象知,溶液体积大小顺序是c>b>a,所以醋酸电离程度最大的是c;导电能力越强,离子浓度越大,氢离子浓度越大,则a、b、c三点溶液的氢离子浓度由小到大的顺序为为c<a<b,则pH由小到大的顺序是b<a<c,故答案为:c;b<a<c;
(3)若使c点溶液中的c(CH3COO-)增大,可以采用升高温度、加入含有醋酸根离子的可能性盐、加入固体碱或加入和氢离子反应的固体物质。A.醋酸是弱电解质,电离时需要吸收热量,所以加热促进醋酸电离,导致醋酸根离子浓度最大,故正确;B.加很稀的NaOH溶液,促进醋酸电离,但醋酸电离程度远远小于溶液体积增大程度,所以醋酸根离子浓度减小,故错误;C.加KOH固体,KOH和醋酸发生中和反应生成醋酸钠,促进醋酸电离,溶液体积不变,醋酸根离子浓度增大,故正确;D.加水促进醋酸电离,但醋酸电离程度远远小于溶液体积增大程度,所以醋酸根离子浓度减小,故错误;E.加固体CH3COONa,醋酸钠电离出醋酸根离子导致醋酸根离子浓度增大,故正确;F.加入锌粒,锌和氢离子发生置换反应而促进醋酸电离,则醋酸根离子浓度增大,故正确;故选ACEF;
(4)A、在稀释过程中,溶液的体积增大,各组分的浓度减小,故A错误;B、弱电解质越稀,电离度越大,即电离出的氢离子数越多,故B正确;C、弱电解质越稀,电离度越大,平衡向右移动,CH3COOH分子数减少,故C错误;D、在稀释过程中,溶液的体积增大,各组分的浓度减小,但是醋酸根离子和氢离子减小的趋势小于醋酸浓度减小的趋势,所以c(H+)/c(CH3COOH)增大,故D正确;故选BD;
(5)A.根据电荷守恒,CH3COOH溶液中各离子浓度的关系为c(H+)=c(OH-)+c(CH3COO-),故A正确;B.向0.10 mol/L的CH3COOH溶液中加水,溶液的酸性减弱,c(H+)减小,故B错误;C.CH3COOH为弱酸,根据电荷守恒,CH3COOH溶液中各离子浓度的关系为c(H+)=c(OH-)+c(CH3COO-),溶液中各离子浓度的关系为c(H+)>c(CH3COO-)> c(OH-),故C错误;D.常温下,醋酸为弱酸,c(H+)=0.01 mol/L的CH3COOH溶液的浓度大于0.01 mol/L,氢氧化钠为强碱,c(OH-)=0.01 mol/L的NaOH溶液浓度等于0.01 mol/L,等体积混合后,醋酸过量,溶液呈酸性,故D错误;故选A。

【题目】在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表所示:
时间/(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)在第5 s时,NO的转化率为_________________________________。
(2)如图中表示NO2变化曲线的是______________________。
用O2表示0~2 s内该反应的平均速率v=______________________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS 等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的离子反应方程式为_________________________;
(2)“溶解”时放出的气体为_______________ (填化学式);
(3)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为______________________;
(4)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式_____________;

(5)金属铬在溶液中有多种存在形式, CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72—)随c(H+)的变化如图所示,用离子方程式表示Na2CrO4溶液中的转化反应________________,根据A点数据计算出该转化反应的平衡常数为______________,温度升高,溶液中CrO42—的平衡转化率减小,则该反应的△H____0(填“>”、“<”或“=”)。
【题目】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)以便固体溶解。该步反应的离子方程式为 (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是 ;使用萃取剂适宜的pH=____(填序号)左右:

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)= 。
【题目】硫代硫酸钠(Na2S2O3)俗称保险粉,可用作照相定影剂、纸浆漂白脱氯剂等。
实验室可通过反应2Na2S+Na2CO3+4SO2→3Na2S2O3+CO2制取Na2S2O3,装置如图所示。
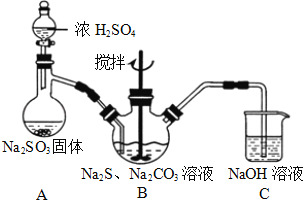
(1)装置B中搅拌器的作用是______;装置C中NaOH溶液的作用是_____。
(2)请对上述装置提出一条优化措施_______________________。
为测定所得保险粉样品中Na2S2O35H2O的质量分数,称取3.000g Na2S2O35H2O样品配成100mL溶液,用0.100mol/L标准碘溶液进行滴定,反应方程式为:2Na2S2O3+I2→2NaI+Na2S4O6
(3)滴定时用__________作指示剂,滴定时使用的主要玻璃仪器有________________。
(4)滴定时,若看到溶液局部变色就停止滴定,则样品中Na2S2O35H2O的质量分数测定值__________(填“偏高”、“偏低”或“不变”)。
(5)某学生小组测得实验数据如下:
实验次数 | 样品溶液体积(ml) | 滴定消耗0.100mol/L碘溶液体积(ml) |
1 | 20.00 | 9.80 |
2 | 20.00 | 10.70 |
3 | 20.00 | 9.90 |
该样品中Na2S2O35H2O的质量分数是_______。(精确到0.001)
