题目内容
下列说法正确的是( )
| A.形成离子键的阴阳离子间只存在静电吸引力 |
| B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
| C.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| D.元素周期律是元素原子核外电子排布周期性变化的结果 |
D
解析试题分析:A.形成离子键的阴阳离子间存在静电吸引力和静电排斥力,错误;B.HF、HCl、HBr、HI的热稳定性从左到右依次减弱,还原性逐渐增强,错误;C.第三周期非金属元素的最高价含氧酸的酸性从左到右依次增强,错误;D.元素周期律是就是由于元素原子核外电子排布周期性变化的原因造成的,正确。
考点:考查元素的性质与元素的原子结构变化的关系的知识。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
在元素周期表中金属与非金属的分界处,可以找到
| A.合金 | B.半导体材料 | C.催化剂 | D.农药 |
在短周期中,R原子最外层电子数是其次外层电子数的3倍,下列说法不正确的是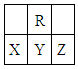
| A.原子半径大小:X >Y>Z |
| B.氢化物的稳定性:X >Y |
| C.化合物YR2能使品红溶液褪色 |
| D.X、Y、Z三种元素最高价氧化物的水化物的酸性最强的是Z |
下列元素中,金属性最强的是
| A.K | B.Al | C.He | D.S |
目前,人类已经发现的非金属元素除稀有气体元素外共有16种,下列对这16种非金属元素的判断不正确的是 ( )
①都是主族元素,原子的最外层电子数都大于3 ②单质在反应中都只能作氧化剂
③对应的含氧酸都是强酸 ④氢化物常温下都是气态,所以又叫气态氢化物
⑤气态氧化物与水反应都不会再生成气体
| A.全部 | B.只有①② | C.只有①②③④ | D.只有①②④⑤ |
XY2是由短周期元素形成的化合物,Y-比X2+多一个电子层,且与氩原子的电子层结构相同。下列有关叙述不正确的是( )
| A.X是第二周期元素 | B.Y是第ⅦA族元素 |
| C.Y-与X2+的最外层电子数相同 | D.化合物XY2的化学键为离子键 |
下列气态氢化物最不稳定的是( )
| A.SiH4 | B.PH3 | C.H2S | D.HF |
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是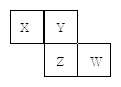
| A.原子半径:W> Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.4种元素的单质中,Z单质的熔、沸点最低 |
| D.W单质能与水反应,生成一种具有漂白性的物质 |