题目内容
20.25℃101KPa,将1molCH4与一定量的O2混合后,充入一密闭绝热容器内,在连续电火花的作用下反应,恢复至原状况放出QkJ热量,容器内无CH4和O2剩余,装置内气体全部通入足量的碱石灰后,剩余bmol气体.则:(1)反应开始时CH4与O2的物质的量之比为2:(4-b)
(2)若已知 C(s)+O2(g)=CO2(g)△H1=-m kJ/molCO2(g)+C(s)=2CO(g)△H2=+n kJ/mol,则CO的燃烧热为-$\frac{(n+m)}{2}$KJ/mol.表示CH4燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-($\frac{b(n+m)}{2}$+Q)KJ/mol.
分析 (1)由题意可知,剩余气体为CO物质的量为 b mol,利用方程式CH4+2O2=2H2O+CO2,CH4+$\frac{3}{2}$O2=2H20+C0,列出方程组解答;
(2)利用热化学方程式根据盖斯定律求出CO的燃烧热;根据题意,由元素守恒可得:1mol甲烷与一定量氧气反应除生成二氧化碳外,还生成bmol的CO气体,所以甲烷部分燃烧的热化学方程式为:CH4(g)+(2-b/2)O2(g)=bCO(g)+(1-b)CO2(g)+2H2O(l)△H=-QKJ/mol ①
C(s)+O2(g)=CO2(g)△H1=-m kJ/mol ②
CO2(g)+C(s)=2CO(g)△H2=+n kJ/mol ③
$\frac{②-③}{2}$得:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-$\frac{(n+m)}{2}$KJ/mol④
则①+④×b,得CH4完全燃烧的热化学方程式.
解答 解:(1)剩余气体为CO物质的量为bmol
于是有:CH4+2O2 =2H2O+CO2
1-b mol 2(1-b)mol
CH4 +$\frac{3}{2}$O2=2H20+C0
bmol $\frac{3}{2}$b mol b mol
那么反应开始时CH4与O2的物质的量之比为:1:[2(1-b)mol+3/2 b mol]=2:(4-b);
故答案为:2:(4-b)
(2)C(s)+O2(g)=CO2(g)△H1=-m kJ/mol ②
CO2(g)+C(s)=2CO(g)△H2=+n kJ/mol ③
$\frac{②-③}{2}$得:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-$\frac{(n+m)}{2}$KJ/mol
所以CO的燃烧热△H为-$\frac{(n+m)}{2}$KJ/mol;
根据题意,由元素守恒可得:1mol甲烷与一定量氧气反应除生成二氧化碳外,还生成bmol的CO气体,所以甲烷部分燃烧的热化学方程式为:
CH4(g)+(2-b/2)O2(g)=bCO(g)+(1-b)CO2(g)+2H2O(l)△H=-QKJ/mol ①
C(s)+O2(g)=CO2(g)△H1=-m kJ/mol ②
CO2(g)+C(s)=2CO(g)△H2=+n kJ/mol ③
$\frac{②-③}{2}$得:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-$\frac{(n+m)}{2}$KJ/mol④
则①+④×b,得CH4完全燃烧的热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-($\frac{b(n+m)}{2}$+Q)KJ/mol;
故答案为:△H=-$\frac{(n+m)}{2}$KJ/mol;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-($\frac{b(n+m)}{2}$+Q)KJ/mol.
点评 本题考查了用盖斯定律进行有关反应热的计算,难度较大,对已知热化学方程式进行变形是解题的关键.

 名校课堂系列答案
名校课堂系列答案| A. | 氯水 | B. | 胶体 | C. | 冰水混合物 | D. | 浓硫酸 |
| A. | CCl4的电子式: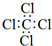 | B. | 乙烯的球棍模型 | ||
| C. | 乙酸的最简式:CH2O | D. | 丙烯醛的结构简式:CH2CHCHO |
| A. | 生活垃圾分类收集 | B. | 垃圾进行露天焚烧 | ||
| C. | 宣传“低碳”出行 | D. | 合理使用化肥农药 |
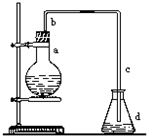 实验室用下图装置制取少量溴苯,试填写下列空白.
实验室用下图装置制取少量溴苯,试填写下列空白.