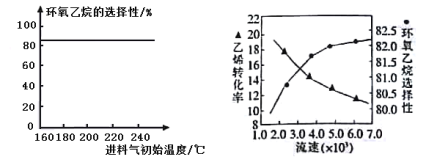
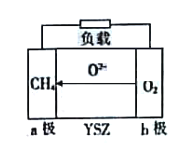
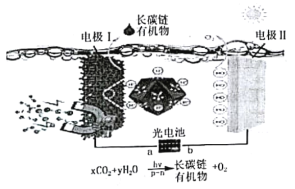
题目内容
【题目】为了探究KI与FeCl3的反应为可逆反应,且有一定的限度,某化学小组进行了两组实验:
(1)请写出KI溶液与FeCl3溶液反应的离子反应方程式:______;
实验I:探究KI与FeCl3的反应为可逆反应
步骤1:设计如下图原电池装置,接通灵敏电流计,指针向左偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
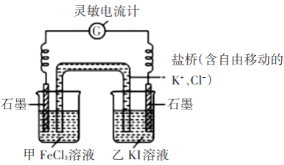
步骤2:当指针读数变零后,向甲中加入少量FeCl2固体,向乙中加入少量碘固体;
(2)若灵敏电流计出现_________(答现象),则证明该反应为可逆反应。实验结论:该反应为可逆反应。
(3)根据以上实验结论解释步骤1中“最后读数变为零”的原因_______;
(4)加入FeCl2和碘固体后,正极的电极反应式为______;
实验II:证明KI与FeCl3的反应有一定限度。
步骤3:取5 mL 0.1 mol/L的KI溶液于试管,滴加0.1 mol/L的FeCl3溶液2 mL,振荡;
步骤4:取少量反应后的溶液,向其中加入几滴淀粉溶液,充分振荡;
(5)观察到的现象是________;
步骤5:另取少量反应后的溶液,滴加0.1 mol/L的AgNO3溶液,振荡,产生黄色沉淀,则证明该反应有一定限度。
(6)但有同学认为步骤5现象不能证明得出的结论,原因是______,修正实验方案后得到结论:该反应有一定的限度。
【答案】2Fe3++2I-=2Fe2++I2 电流计指针偏向右侧 该反应达到了平衡状态 I2+2e-=2I- 溶液变蓝 I-过量,造成溶液中仍有残留
【解析】
KI溶液与FeCl3溶液反应的离子反应方程式:2Fe3++2I-![]() 2Fe2++I2,实验I:为探究KI与FeCl3的反应为可逆反应,设计带盐桥的原电池实验进行验证,改变生成物浓度,看电流计的指针否逆向偏转,如能逆向偏转,随着时间进行电流计读数逐渐变小,最后读数变为零,说明反应是可逆反应;实验II:证明KI与FeCl3的反应有一定限度。取5 mL 0.1 mol/L的KI溶液于试管,滴加0.1 mol/L的FeCl3溶液2 mL,反应后碘离子过量(5 mL× 0.1 mol·L-1-2×0.1 mol/L×2 mL)=1mmol,要增加FeCl3溶液量,确保铁离子过量,再检验碘离子才正确。
2Fe2++I2,实验I:为探究KI与FeCl3的反应为可逆反应,设计带盐桥的原电池实验进行验证,改变生成物浓度,看电流计的指针否逆向偏转,如能逆向偏转,随着时间进行电流计读数逐渐变小,最后读数变为零,说明反应是可逆反应;实验II:证明KI与FeCl3的反应有一定限度。取5 mL 0.1 mol/L的KI溶液于试管,滴加0.1 mol/L的FeCl3溶液2 mL,反应后碘离子过量(5 mL× 0.1 mol·L-1-2×0.1 mol/L×2 mL)=1mmol,要增加FeCl3溶液量,确保铁离子过量,再检验碘离子才正确。
(1)KI溶液与FeCl3溶液反应的离子反应方程式:2Fe3++2I-=2Fe2++I2;故答案为:2Fe3++2I-=2Fe2++I2;
(2)当指针读数变零后,向甲中加入少量FeCl2固体,向乙中加入少量碘固体,若灵敏电流计出现电流计指针偏向右侧,说明反应逆向进行,则证明该反应为可逆反应。实验结论:该反应为可逆反应。故答案为:电流计指针偏向右侧;
(3)改变亚铁离子浓度后,旧平衡被破坏,平衡逆向移动,步骤1中“最后读数变为零”的原因该反应重新达到了平衡状态;故答案为:该反应达到了平衡状态;
(4)加入FeCl2和碘固体后,平衡逆向进行,负极亚铁离子失电子,发生氧化反应,正极是碘作氧化剂,得电子发生还原反应,正极的电极反应式为I2+2e-=2I-;故答案为:I2+2e-=2I-;
(5)取5 mL 0.1 mol/L的KI溶液于试管,滴加0.1 mol/L的FeCl3溶液2 mL,振荡,发生2Fe3++2I-=2Fe2++I2,有碘单质生成,遇淀粉溶液变蓝,观察到的现象是溶液变蓝;故答案为:溶液变蓝;
(6)步骤3:取5 mL 0.1 mol/L的KI溶液于试管,滴加0.1 mol/L的FeCl3溶液2 mL,反应后碘离子过量(5 mL× 0.1 mol·L-1-2×0.1 mol/L×2 mL)=1mmol,步骤5:另取少量反应后的溶液,滴加0.1 mol/L的AgNO3溶液,振荡,产生黄色沉淀,步骤5现象不能得出反应有限度的结论,原因是I-过量,造成溶液中仍有残留,要增加FeCl3溶液量,确保铁离子过量,再检验碘离子才正确,修正实验方案后得到结论:该反应有一定的限度。故答案为:I-过量,造成溶液中仍有残留。

 每课必练系列答案
每课必练系列答案【题目】化合物W是合成一种抗心律失常药物的中间物质,一种合成该物质的路线如下:

(1)ClCH2CH2C1的名称是____________。
(2)E中不含氧的官能团的名称为____________。
(3)C的分子式为__________,B→C的反应类型是____________。
(4)筛选C→D的最优反应条件(各组别条件得到的D的产率不同)如下表所示:
组别 | 加料温度 | 反应溶剂 | AlCl3的用量(摩尔当量) |
① | -30~0℃ |
| 1 eq |
② | -20~-10℃ |
| 1 eq |
③ | -20~-10℃ | ClCH2CH2Cl | 1 eq |
上述实验筛选了________和________对物质D产率的影响。此外还可以进一步探究___________对物质D产率的影响。
(5)M为A的同分异构体,写出满足下列条件的M的结构简式:__________________。
①除苯环外不含其他环;②有四种不同化学环境的氢,个数比为1:1:2:2;③1 mol M只能与1mol NaOH反应。
(6)结合上述合成路线,写出以![]() 、CH3I和SOCl2为基本原料合成
、CH3I和SOCl2为基本原料合成![]() 的路线图。(其他所需无机试剂及溶剂任选)
的路线图。(其他所需无机试剂及溶剂任选)
已知,RCOOH![]() RCOCl。
RCOCl。
____________________________________________________________________________________________。