题目内容
13.设NA为阿伏加德罗常数,则下列叙述中正确的是( )| A. | 6.02×1022个H2SO4分子在水中可电离生成2NA个H+ | |
| B. | 在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 14 g氮气中含有7NA个电子 | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
分析 A、求出H2SO4的物质的量n=$\frac{N}{{N}_{A}}$,然后根据1molH2SO4能电离出2mol氢离子来分析;
B、求出氢气的物质的量n=$\frac{V}{{V}_{m}}$,然后根据1mol氢气含2mol氢原子来计算;
C、求出氮气的物质的量n=$\frac{m}{M}$,然后根据1mol氮气含14mol电子来分析;
D、根据m=$\frac{N}{{N}_{A}}M$和m=nM来计算出CO和甲烷的质量.
解答 解:A、6.02×1022个H2SO4的物质的量n=$\frac{N}{{N}_{A}}$=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}}$=0.1mol,而1molH2SO4能电离出2mol氢离子,故0.1mol硫酸在水中能电离出0.2mol氢离子,即0.2NA个,故A错误;
B、0℃、101 kPa即标况,气体摩尔体积为22.4L/mol,则22.4L氢气的物质的量n=$\frac{V}{{V}_{m}}$=$\frac{22.4L}{22.4L/mol}$=1mol,而1mol氢气含2mol氢原子,即2NA个,故B错误;
C、14g氮气的物质的量n=$\frac{m}{M}$=$\frac{14g}{28g/mol}$=0.5mol,而1mol氮气含14mol电子,故0.5mol氮气含7mol氮原子,即7NA个,故C正确;
D、NA个CO的质量m=$\frac{N}{{N}_{A}}M$=28g,0.5mol甲烷的质量m=nM=0.5mol×16g/mol=8g,故质量比为28g:8g=7:2,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 | |
| B. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| C. | 在一个基态多电子的原子中,M层上的电子能量肯定比N层上的电子能量低 | |
| D. | 在一个基态多电子的原子中,如果某一能级上有多个未成对电子,它们自旋方向必然相同 |
①分子中一定含有C、H、O三元素
②分子中C、H、O原子个数比为1:2:3
③分子中C、H原子的个数比为1:2
④分子中肯定不含有氧原子.
| A. | ①② | B. | ③④ | C. | ①③ | D. | 只有③ |
| A. | (0.4 Q1+0.05 Q3) kJ | B. | (0.4 Q1+0.05 Q2) kJ | ||
| C. | (0.4 Q1+0.1 Q3) kJ | D. | (0.4Q1+0.2 Q1) kJ |
| A. | 元素的非金属性:X<Y<Z | B. | X、Y、Z依次位于ⅤA族、ⅥA族、ⅦA族 | ||
| C. | 阴离子的还原性:X->Y2->Z3- | D. | 气态氢化物的稳定性:HX>H2Y>ZH3 |
| A. | 向Na2SiO3溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失 | |
| B. | 向Na2CO3饱和溶液中通入CO2溶液变浑浊,继续通入CO2,有晶体析出 | |
| C. | 向Ca(ClO)2溶液中通入CO2溶液变浑浊,再加入品红溶液,红色褪去 | |
| D. | 向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失,再加入过量NaOH溶液,溶液又变浑浊 |
| A. | 丁烷中碳、氢原子的个数比为4:10 | |
| B. | 丁烷中碳、氢两种元素的质量比是4:10 | |
| C. | 丁烷由碳、氢两种元素组成 | |
| D. | 一个丁烷分子由4个碳原子和10个氢原子构成 |
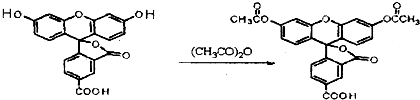
5-羧基荧光素(5-FAM) 5-羧基荧光素二乙酸酯(5-CFDA)
| A. | 5-FAM转变为5-CFDA属于取代反应 | |
| B. | 实验室鉴别5-FAM与5-CFDA可用碳酸氢钠溶液 | |
| C. | 5-FAM的分子式为:C21H3O7 | |
| D. | 5-FAM和5-CFDA分子中的所有原子均共面 |