题目内容
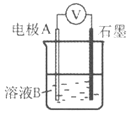
【题目】某小组同学利用原电池装置探究物质的性质。
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| I | Fe | pH=2的 H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的 H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验I中铁主要发生了析氢腐蚀,其负极反应式是__________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其理论判断依据是__________;
乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是__________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性的因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
V | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验II、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是__________。
②丁同学对Ⅳ、V进行比较,其目的是探究__________对O2氧化性的影响。
③实验Ⅳ中加入Na2SO4溶液的目的是__________。
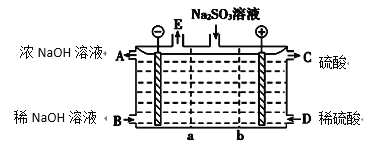
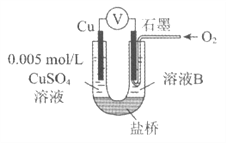
④为达到丁同学的目的,经讨论,同学们认为应改用下图装置对Ⅳ、V重复进行实验,其设计意图是_________;重复实验时,记录电压表读数依次为c'、d',且c'>d',由此得出的结论是__________。
【答案】 Fe—2e-=Fe2+ 在金属活动性顺序中,Cu在H后,Cu不能置换出H2 O2+4H++4e-=2H2O O2浓度越大,其氧化性越强,使电压值增大 溶液的酸碱性 排除溶液中的Na+(或SO42-)对实验的可能干扰 排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响 溶液酸性越强,O2的氧化性越强(介质或环境的pH影响物质的氧化性)
【解析】分析:(1).①.I中的铁主要发生析氢腐蚀,铁在负极失电子发生氧化反应;②.铜与氢离子不能发生自发的氧化还原反应;乙同学认为实验Ⅱ中应发生吸氧腐蚀,则在正极上氧气得电子发生还原反应生成水;(2). ①.实验Ⅱ、Ⅲ、IV的电解质相同,不同的是氧气的浓度,出现了电压表读数不同,根据数值的相对大小可知,氧气浓度越大,电压表的读数越高;②.实验Ⅳ、V是利用电解质溶液的酸碱性不同,来判断电压表的指针偏转情况;③.实验IV中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)对实验的可能干扰;④.为达到丁同学的目的,经讨论,同学们认为应改用如图装置对IV、V重复进行实验,其设计意图是排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;重复实验时,记录电压表读数依次为c'、d',且c'>d',说明溶液酸性越强,O2的氧化性越强。
详解:(1). ①. I中的铁主要发生析氢腐蚀,则铁在负极失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
②. 在金属活动性顺序中,Cu在H的后面,铜与氢离子不能发生自发的氧化还原反应;乙同学认为实验Ⅱ中应发生吸氧腐蚀,则在正极上氧气得电子发生还原反应生成水,其正极的电极反应式是O2+4H++4e-=2H2O,故答案为:在金属活动性顺序中,Cu在H后,Cu不能置换出H2;O2+4H++4e-=2H2O;
(2). ①. 实验Ⅱ、Ⅲ、IV的电解质相同,不同的是氧气的浓度,出现了电压表读数不同,根据数值的相对大小可知,氧气浓度越大,电压表的读数越高,所以O2浓度越大,其氧化性越强,使电压值增大,故答案为:O2浓度越大,其氧化性越强,使电压值增大;
②. 在实验Ⅳ、V中是利用溶液的酸碱性不同来判断电压表的指针偏转情况,所以Ⅳ、V进行比较,其目的是探究溶液的酸碱性对O2氧化性的影响,故答案为:溶液的酸碱性;
③. 实验IV中加入Na2SO4溶液的目的是排除溶液中的Na+(或SO42-)对实验的可能干扰,故答案为:排除溶液中的Na+(或SO42-)对实验的可能干扰;
④. 为达到丁同学的目的,经讨论,同学们认为应改用如图装置对Ⅳ、V重复进行实验,其设计意图是排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;重复实验时,记录电压表读数依次为c'、d',且c'>d',由此得出的结论是溶液酸性越强,O2的氧化性越强,故答案为:排除Cu在酸碱性不同的溶液中,其还原性不同对该实验结果的影响;溶液酸性越强,O2的氧化性越强(介质或环境的pH影响物质的氧化性)。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是
A. 反应开始到平衡过程中气体的平均相对分子质量不变
B. 若要提高SO2的转化率,可鼓入过量空气
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4