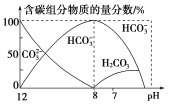
题目内容
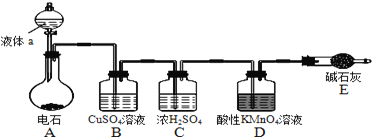
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:
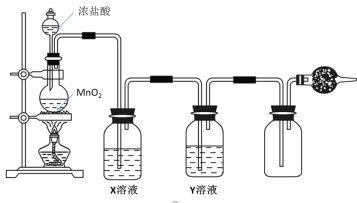
(1)写出实验室制取氯气的离子方程式_____________,NA表示阿伏加德罗常数的值,若有3mol的HCl被氧化,则转移的电子总数为______;将足量的MnO2投入含4molHCl的浓盐酸中,充分加热,可生成的Cl2________(填“>”“=”或“<”)1mol。
(2)现有3种试剂可供选择:A.饱和食盐水 B.浓硫酸 C.NaOH溶液,则Y溶液应选用________(填字母),X溶液的作用是_______。
【答案】MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑ 3NA < B 除去Cl2中的HCl
Mn2++2H2O+Cl2↑ 3NA < B 除去Cl2中的HCl
【解析】
实验室中一般利用浓盐酸和二氧化锰共热制取氯气,生成的氯气中混有HCl气体,可以用饱和食盐水除去,之后再用浓硫酸进行干燥,氯气的密度比空气大,可以用向上排空气法收集,氯气会污染空气,所以多余的氯气要进行处理。
(1)浓盐酸和二氧化锰共热制取氯气,离子方程式为MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2↑;HCl被氧化生成Cl2,化合价升高1价,所以3molHCl被氧化转移的电子总数为3NA;由于浓盐酸在反应过程中会变稀,而稀盐酸与二氧化锰不反应,所以生成的氯气小于1mol;
Mn2++2H2O+Cl2↑;HCl被氧化生成Cl2,化合价升高1价,所以3molHCl被氧化转移的电子总数为3NA;由于浓盐酸在反应过程中会变稀,而稀盐酸与二氧化锰不反应,所以生成的氯气小于1mol;
(2)根据分析可知Y选用浓硫酸,即B;X选用饱和食盐水,除去Cl2中的HCl。

【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2