题目内容
【题目】如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.
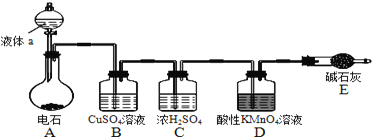
(1)写出实验室制取乙炔的化学方程式:______ .
(2)实验室制取乙炔时,分液漏斗中的液体a通常是______ .
(3)![]() 溶液的作用是______ .
溶液的作用是______ .
(4)装置D中的现象是:______ .
(5)工业上常用乙炔、二氧化锰和浓盐酸等物质作原料来合成聚氯乙烯,请写出相关方程式:___________
【答案】CaC2+2H2O→Ca(OH)2+C2H2↑ 饱和食盐水 吸收杂质气体硫化氢、磷化氢等 高锰酸钾溶液褪色 ![]() ;HCl+CH≡CH→ClCH=CH2 nClCH=CH2→
;HCl+CH≡CH→ClCH=CH2 nClCH=CH2→ 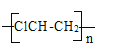
【解析】
实验室制备乙炔利用碳化钙和水反应生成乙炔和氢氧化钙,为减慢反应速率,可以用饱和食盐水代替水,反应产生的乙炔气体中混有硫化氢、磷化氢等杂质气体,会对乙炔性质实验造成干扰,可以用硫酸铜溶液进行吸收;乙炔属于不饱和烃,能够与酸性高锰酸钾溶液发生氧化反应,导致其褪色,乙炔与氯气可以发生加聚反应生成高分子,据以上分析进行解答。
(1)实验室制备乙炔利用碳化钙和水反应生成乙炔和氢氧化钙,反应为CaC2+2H2O→Ca(OH)2+C2H2↑;所以答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)电石与水反应速率太快,通常利用饱和食盐水代替水以减慢化学反应速率,故答案为:饱和食盐水;
(3)此反应中会产生杂质气体,硫化氢、磷化氢,会对乙炔性质实验造成干扰,利用硫酸铜溶液吸收硫化氢、磷化氢气体,以避免干扰,故答案为:吸收杂质气体硫化氢、磷化氢等; (4)乙炔含有碳碳三键,能与高锰酸钾溶液反应使其褪色,因此答案为:高锰酸钾溶液褪色;
5)工业上常用二氧化锰和浓盐酸反应生成氯气,氯气和乙炔发生聚合反应生成聚氯乙烯,其反应的相关化学反应方程式为: ![]() ,HCl+CH≡CH→ClCH=CH2,nClCH=CH2→
,HCl+CH≡CH→ClCH=CH2,nClCH=CH2→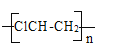 ,所以本题答案:
,所以本题答案:![]() ,HCl+CH≡CH→ClCH=CH2,nClCH=CH2→
,HCl+CH≡CH→ClCH=CH2,nClCH=CH2→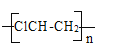 。
。