题目内容
【题目】N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图所示:
2NH3(g) ΔH=-92.4KJ/mol。在500℃、20MPa时,将N2和H2通入到体积为2L的密闭容器中,反应过程中各种物质的物质的量变化如图所示:
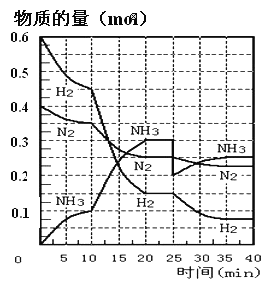
(1)10min内用NH3表示该反应的平均速率,v(NH3)= _______。
(2)在10-20min内NH3浓度变化的原因可能是_______(填字母)。
a.加了催化剂 b.降低温度 c.增加NH3的物质的量
(3)该可逆反应达到平衡的标志是___(填字母)
a.3v(H2)正=2v(NH3)逆
b.混合气体的密度不再随时间变化
c.容器内的总压强不再随时间而变化
d.N2、H2、NH3的分子数之比为1:3:2
e.单位时间生成mmolN2的同时消耗3mmolH2
f.amolN=N键断裂的同时,有6amolN-M键合成
(4)第一次平衡时,平衡常数K1=____(用数学表达式表示)。NH3的体积分数是_____(保留2位小数)。
(5)在反应进行到25min时,曲线发生变化的原因是______。
(6)已知:N2(g)+3H2![]() 2NH3(g) ΔH=-92.4KJ/mol
2NH3(g) ΔH=-92.4KJ/mol
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6KJ/mol
2H2O(g) ΔH=-483.6KJ/mol
氨气完全燃烧生成气态水的热化学方程式是______
(7)安阳燃料电池具有很大的发展潜力。安阳燃料电池工作原理如图所示:
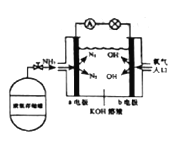
①b电极的电极反应式是_________;
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是_____。
【答案】 v(NH3)= 0.005 mol/(L·min) a c e 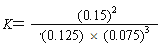 42.86% 移走了生成的氨气(或减小了氨气的浓度) 4NH3(g) + 3O2(g)
42.86% 移走了生成的氨气(或减小了氨气的浓度) 4NH3(g) + 3O2(g) ![]() 2N2(g) + 6H2O(g) ΔH =-1266.0 kJ/mol O2 + 4e- + 2H2O= 4OH- 由于发生4NH3 + 3O2
2N2(g) + 6H2O(g) ΔH =-1266.0 kJ/mol O2 + 4e- + 2H2O= 4OH- 由于发生4NH3 + 3O2![]() 2N2 + 6H2O 反应,有水生成,使得溶液逐渐变稀,所以要补充KOH。
2N2 + 6H2O 反应,有水生成,使得溶液逐渐变稀,所以要补充KOH。
【解析】(1)根据反应速率的表达式,c(NH3)=0.1/(2×10)mol/(L·min)=0.005mol/(L·min);(2)由图像可知,各组分物质的量变化增加,,且10min时变化是连续的,20min达到平衡时,N2的物质的量变化量为0.025×4mol=0.1mol,氢气的物质的量变化量为0.025×12mol=0.3mol,NH3物质的量变化量为0.025×8mol=0.2mol,物质的量变化之比等于化学计量时之比,三种气体物质的速率增加倍数相同,说明使用了催化剂,故选项a正确;(3)a、用不同物质反应速率判断达到平衡,要求反应方向一正一逆,且反应速率之比等于化学计量数之比,v正(H2)向正反应方向进行,v逆(NH3)向逆反应方向进行,v正(H2)/v逆(NH3)=3:2,应是2v正(H2)=3v逆(NH3),故错误;b、组分都是气体,气体质量保持不变,又是恒容状态,因此密度不变,不能说明反应达到平衡,故错误;c、反应前后气体系数之和不相等,因此压强不变,说明反应达到平衡,故正确;d、因为不知道开始时投入量是多少,因此分子数之比不能判断是否达到平衡,故错误;e、反应方向一正一逆,且等于反应速率之比,因此达到平衡,故正确;f、反应方向都是向正反应方向进行,因此不能说明达到平衡,故错误;(4)根据平衡常数的定义,表达式为K1=c2(NH3)/[c(N2)×c3(H2)],在20min时第一次达到平衡,n(N2)=0.25mol,n(H2)=0.15mol,n(NH3)=0.3mol,因此有K=(0.3/2)2/[(0.25/2)×(0.15/2)3]或者 ,NH3的体积分数为0.3/(0.25+0.15+0.3)×100%=42.86%;(5)根据图像,第25min时,氨气的量突然减小,而其他物质的量不变,说明此时刻移出NH3或分离出NH3;(6)①N2(g)+3H2(g)
,NH3的体积分数为0.3/(0.25+0.15+0.3)×100%=42.86%;(5)根据图像,第25min时,氨气的量突然减小,而其他物质的量不变,说明此时刻移出NH3或分离出NH3;(6)①N2(g)+3H2(g) ![]() 2NH3(g),②2H2(g)+O2(g)=2H2O(g),②×3-2×①得出:4NH3(g) + 3O2(g)
2NH3(g),②2H2(g)+O2(g)=2H2O(g),②×3-2×①得出:4NH3(g) + 3O2(g) ![]() 2N2(g) + 6H2O(g) ΔH =-1266.0 kJ/mol ;(7)①根据工作原理,b极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-;②总电极反应是4NH3+O2
2N2(g) + 6H2O(g) ΔH =-1266.0 kJ/mol ;(7)①根据工作原理,b极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-;②总电极反应是4NH3+O2![]() 2N2+6H2O,KOH的浓度降低,因此需要补充KOH。
2N2+6H2O,KOH的浓度降低,因此需要补充KOH。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案




