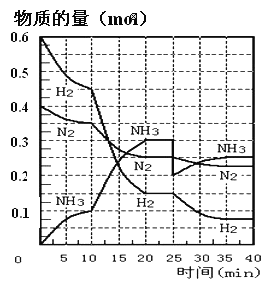
题目内容
【题目】(2015天津)随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:

① R离子浓度由大到小的顺序是:__________。
② 写出m点反应的离子方程式_________________。
③ 若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______mol。
【答案】(1)第三周期ⅢA族 (2)r(O2-)>r(Na+)、HClO4>H2SO4
(3)![]() (或
(或![]()
![]() )
)
(4)2Na(s)+O2(g) =Na2O2(s) △H=-511kJ·mol-1
(5) ① c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-)
② NH4+ + OH-=NH3·H2O ③0.022
【解析】从图中的化合价和原子半径的大小,可以退出x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素。(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族。(2)电子层结构相同的离子,核电荷数越大离子半径越小,故r(O2-)>r(Na+);非金属性越强最高价氧化物水化物的酸性越强,故HClO4>H2SO4
(3)四原子共价化合物,可以是NH3、H2O2、C2H2等,其电子式为:![]() (或
(或![]()
![]() )
)
(4)1molNa的单质在足量O2中燃烧,放出255.5kJ热量,则该反应的热化学方程式为:2Na(s)+O2(g) =Na2O2(s) △H=-511kJ·mol-1
(5)① R是NH4Al(SO4)2, Al3+比 NH4+水解程度更大,故离子浓度由大到小的顺序是:c(SO42-)>c(NH4+)>c(Al3+)>c(H+)>c(OH-)②m点过程中加入氢氧化钠沉淀物质的量不变,是NH4+ 发生了反应,离子方程式为:NH4+ + OH-=NH3·H2O ③ 10mL1mol·L-1 NH4Al(SO4)2,溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol ,SO42-的物质的量为0.02mol, 20mL1.2 mol·L-1Ba(OH)2溶液Ba2+物质的量为0.024mol,OH—为0.048mol,反应生成沉淀为0.022mol。

【题目】下列各组物质,不能按右图(“→”表示反应一步完成)关系转化的是
选项 | a | b | c |
|
A | Cu | CuO | Cu(OH)2 | |
B | SiO2 | Na2SiO3 | H2SiO3 | |
C | AlCl3 | NaAlO2 | Al(OH)3 | |
D | CaO | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D