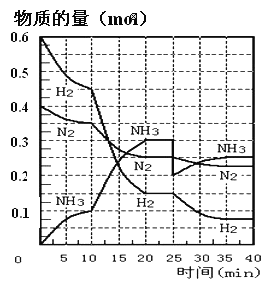
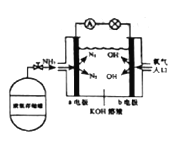
��Ŀ����
����Ŀ�������£���20mLij������Һ����μ���0.1mol/L�İ�ˮ����ҺpH�ı仯����백ˮ�������ϵ��ͼ��ʾ������������ȷ����

A. ��������ʵ���Ũ��Ϊ1mol/L
B. ��������֮�������һ�㣺c��Cl������c��NH4+����c��H+����c��OH����
C. �ڵ�����ʾ��Һ�У���ˮ�������c��OH������10��7mol/L
D. �ڵ�����ʾ��Һ�У�c��NH4+��=c��Cl������c��OH����=c��H+������V ��20
���𰸡�B
�����������������A����δ�Ӱ�ˮʱ�������PH=1��HCl��ǿ�������ȫ���룬�����ӵ�Ũ��=HCl��Ũ�ȣ�������������ʵ���Ũ��=0.1mol/L����A����B�����ü�ֵ����������δ�Ӱ�ˮʱ����Һ��û��笠����ӣ�����c��Cl-����c��NH4+��������Һ�����ԣ��������ӵ�Ũ�ȴ������������ӵ�Ũ��c��H+����c��OH-������B��ȷ��C����������Һ���Ǽ���Һ������ˮ�ĵ��룬������ʾ��Һ�ʼ��ԣ�������ˮ�ĵ��룬������ˮ�������c��OH-����10-7mol/L����C����D������Һ��PH=7ʱ����Һ��c��H+��=c��OH-������Һ�ʵ����ԣ�����c��Cl-��=c��NH4+�����Ȼ����ǿ����������Һ�����ԣ�Ҫʹ��Һ�ʼ��ԣ���ˮ�����ʵ���Ӧ������һЩ����V��20����D����ѡB��

����Ŀ����ҵ������������Ҫ�ɷ�ΪAl2O3������Fe2O3��SiO2�����ʣ���ȡ��ˮ�Ȼ�����һ�ֹ�������ʾ�����£�
��֪��

���� | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
�е�/�� | 57.6 | 180�������� | 300�������� | 1023 |
��1���������б���ʹ����ˮ�ֻӷ���������Ŀ���࣬��������_________________��ֻҪ��д��һ�֣���
��2��������������ͨ����������������Ӧ�������ԭ�������ȹ��ĵ�����________________��
��3��������̼�������ݷ���������V�м������۵�Ŀ����________________��
��4����ȡ��Fe2O3��Al2O3������0.2000g�������ܽ���pH=2.0������Һ�У�50�����ң����Իǻ�ˮ����Ϊָʾ������0.02000 mol/L EDTA����Һ�ζ������е�Fe3+����ȥ18.00 mL��Ȼ����Һ����pH=3.5����������EDTA����Һ25.00 mL����������У�ʹAl3+��EDTA��ȫ��Ӧ���ٵ���ҺpH=4.5����PAN��1-��2-���ż����-2-���ӣ�Ϊָʾ����������CuSO4����Һ��ÿ������CuSO4��5H2O 0.005000g�����ζ�����ȥ8.00 mL������������Fe2O3��Al2O3������������________________��д��������̣�
����֪��EDTA��Fe3+��Al3+��Cu2+�������ʵ���֮��1��1���з�Ӧ��
����Ŀ��Ϊ�ᴿ����������������Ϊ��������ѡ�õ��Լ��ͷ��뷽������ȷ����
���� | �Լ� | ���뷽�� | |
A | ������Һ��NaCl�� | ˮ | ���� |
B | CaCO3��CaO�� | ˮ | ���� |
C | KCl��Һ��I2�� | �ƾ� | ��ȡ |
D | CO2��HCl�� | ����̼��������Һ | ϴ�� |
����Ŀ�����и������ʣ����ܰ���ͼ����������ʾ��Ӧһ����ɣ���ϵת������
ѡ�� | a | b | c |
|
A | Cu | CuO | Cu(OH)2 | |
B | SiO2 | Na2SiO3 | H2SiO3 | |
C | AlCl3 | NaAlO2 | Al(OH)3 | |
D | CaO | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D