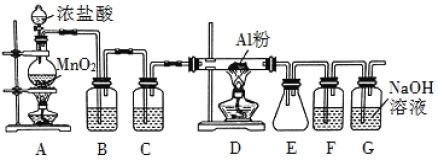
题目内容
【题目】(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的发法:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图1所示(实线).图中数据a(1,6)代表的意思是:在1min时H2的物质的量是6mol。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1.某科学实验将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图1所示(实线).图中数据a(1,6)代表的意思是:在1min时H2的物质的量是6mol。
①a点正反应速率____________(填大于、等于或小于)逆反应速率。
②下列时间段平均反应速率最大的是__________,最小的是__________.
A.0~1min B.1~3min C.3~8min D.8~11min
③仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是__________,曲线Ⅱ对应的实验条件改变是__________。

(2)利用光能和光催化剂,可将 CO2和 H2O(g)转化为 CH4和 O2。紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示。在0~30小时内,CH4的平均生成速率 vⅠ、vⅡ和vⅢ从大到小的顺序为____________;反应开始后的12小时内,在第__________种催化剂作用下,收集的 CH4最多。
(3) 1100 ℃时,体积为2L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g),下列能判断反应达到平衡状态的是__________。
Na2S(s)+4H2O(g),下列能判断反应达到平衡状态的是__________。
A.容器内气体压强不再变化
B.H2的体积分数不再变化
C.lmolH--H键断裂同时2molH--O键形成
D.Na2S的质量不再变化
E.v正(H2)=v逆(H2O)
F.容器内气体密度不再变化
【答案】(1)①大于 ②A D ③升高温度 增大压强
(2)Vm>Vn >Vl II (3)BDEF(4分)
【解析】
试题分析:(1)①a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率;
②分别计算不同时间内的反应速率:0~1min内,v(H2)=![]() =1mol/(Lmin);1~3min内,v(H2)=
=1mol/(Lmin);1~3min内,v(H2)=![]() =0.75mol/(Lmin);3~8min内,v(H2)=
=0.75mol/(Lmin);3~8min内,v(H2)=![]() =0.1mol/(Lmin);8min后达到化学平衡状态,正逆反应速率相等,综合速率为零;所以0~1min内反应速率最大,8~11min反应速率最小,故答案为:A、D;
=0.1mol/(Lmin);8min后达到化学平衡状态,正逆反应速率相等,综合速率为零;所以0~1min内反应速率最大,8~11min反应速率最小,故答案为:A、D;
③曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化,故曲线I是升高温度;曲线Ⅲ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强;
(2)由图2可知,在0~30h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅱ)<△n(Ⅲ),故在0~30h内,CH4的平均生成速率v(Ⅲ)>v(Ⅱ)>v(Ⅰ);由图2可知反应开始后的12小时内,在第Ⅱ种催化剂的作用下,收集的CH4最多;
(3)A.无论反应是否达到平衡状态,容器中压强始终不变,所以不能据此判断是否达到平衡状态,故A错误;B.H2的体积分数不再变化,说明各气体的物质的量不变,故B正确;C.无论反应是否达到平衡状态,都存在1mol H-H键断裂同时形成2mol H-O,所以不能据此判断是否达到平衡状态,故C错误;D.Na2S的质量不再变化,说明正逆反应速率相等,故D正确;E.v正(H2)=v逆(H2O) ,反应达平衡状态,故E正确; F.当混合气体密度不变时,该反应达到平衡状态,故F正确;故选BDEF。

【题目】在一定温度下,l0mL 0.40mol/LH2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平衡反应速率:v(H2O2) ≈3.3×10-2mol/(L·min)
B. 6~10min的平衡反应速率:v(H2O2) <3.3×10-2mol/(L·min)
C. 反应到6min时, c (H2O2)=0.30mol/L
D.反应到6min时,H2O2分解了50%