题目内容
【题目】25℃时,二元酸H3PO3的pKa1、pKa2(pK=-lgK)依次为1.30、6.60,氨水的pKb为4.75。常温时,下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1NH4H2PO3溶液中:c(H3PO3)>c(NH3·H2O)>c(H+)>c(OH-)
B.0.1 mol·L-1H3PO3溶液用NaOH溶液滴定至pH=6.60:c(H2PO3-)=c(HPO32-)
C.0.1 mol·L-1H3PO3溶液用氨水滴定至pH=7.0:c(NH4+)=c(H2PO3- )+c(HPO32-)
D.0.4 mol·L-1氨水与0.2 mol·L-1NaH2PO3等体积混合(体积变化可忽略):c(NH3·H2O)<c(H2PO3-)+2c(H3PO3)+0.1 mol·L-1
【答案】BD
【解析】
A. 二元酸H3PO3的pKa1=1.3小于氨水的pKb为4.75,铵根离子的水解能力强,c(NH3·H2O)>c(H3PO3),故A错误;
B. 0.1 mol·L-1H3PO3溶液用NaOH溶液滴定至pH=6.60,ka2=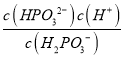 =c(H
=c(H![]() +)=10-6.60,所以c(H2PO3-)=c(HPO32-),故B正确;
+)=10-6.60,所以c(H2PO3-)=c(HPO32-),故B正确;
C. 0.1 mol·L-1H3PO3溶液用氨水滴定至pH=7.0,c(H+)=c(OH-),根据电荷守恒c(H+)+c(NH4+)=c(H2PO3- )+2c(HPO32-)+c(OH-),即:c(NH4+)=c(H2PO3- )+2c(HPO32-),故C错误;
D. 0.4 mol·L-1氨水与0.2 mol·L-1NaH2PO3等体积混合(体积变化可忽略),相当于0.1 mol·L-1Na(NH4)HPO3溶液和0.1 mol·L-1氨水等体积混合,根据电荷守恒:①c(H+)+c(NH4+)+c(Na+)=c(H2PO3- )+2c(HPO32-)+c(OH-),再由物料守恒:②c(NH4+)+c(NH3·H2O)=2c(H2PO3- )+2c(HPO32-)+2c(H3PO3),③c(Na+)=0.1 mol·L-1,②-①得c(NH3·H2O)+c(OH-)=c(H2PO3-)+2c(H3PO3)+c(Na+)+c(H+),将③代入,溶液呈碱性c(H+)<c(OH-),整理得:c(NH3·H2O)<c(H2PO3-)+2c(H3PO3)+0.1 mol·L-1,故D正确;
故选BD。