题目内容
【题目】(化学---选修2:化学与技术)
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水。
(1)硬水是指含有较多______________的水,硬水加热后产生沉淀的离子方程式为:________________________________(写出生成一种沉淀物的即可) 。
(2)硬度为1°的水是指每升水含10 mg CaO或与之相当的物质(如7.1 mg MgO),已知水的硬度在8°以下的称为软水,在8°以上的称为硬水。已知岛上山泉水中c( Ca2+)=1.2×10-3 mol/L,c(Mg2+) =6×l0-4mol/L,那么此水______(填“是”或“否”)属于硬水。
(3)离子交换法是软化水的常用方法。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式__________________。
(4)解放军战士通常向水中加入明矾净水,请用离子方程式解释其净水原理:______________。
(5)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
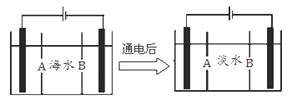
①阳离子交换膜是指___________(填A或B)。
②写出通电后阳极区的电极反应式____________,阴极区的现象是:_______________。
【答案】Ca2+或Mg2+ Ca2++ 2HCO3— ![]() CaCO 3↓+CO 2↑+H2O(或 Mg2++ 2HCO3
CaCO 3↓+CO 2↑+H2O(或 Mg2++ 2HCO3![]() MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O ) 是 CH2=CHCOONa Al3++3H2O
MgCO3↓+CO2↑+H2O MgCO3+2H2O=Mg(OH)2+CO2↑+H2O ) 是 CH2=CHCOONa Al3++3H2O![]() Al(OH)3(胶体)+3H+ B 2Cl--2e-= Cl2↑ 电极上产生气泡,溶液中出现少量白色沉淀
Al(OH)3(胶体)+3H+ B 2Cl--2e-= Cl2↑ 电极上产生气泡,溶液中出现少量白色沉淀
【解析】
(1)硬水是含有较多可溶性钙盐、镁盐的水,硬水中的碳酸氢钙受热分解生成碳酸钙沉淀;
(2)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(3)聚丙烯酸钠的单体为丙烯酸钠;
(4)铝离子水解生成氢氧化铝和氢离子,氢氧化铝具有吸附性能够吸附杂质颗粒,可以用来净水;
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;
②根据阳极是氯离子放电,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大。
(1)硬水是含有较多可溶性钙盐、镁盐的水,硬水中的碳酸氢钙受热分解生成碳酸钙沉淀,方程式为:Ca2++2HCO3-![]() CaCO3↓+CO2↑+H2O;
CaCO3↓+CO2↑+H2O;
(2)某天然水中c(Ca2+)=1.2×10-3mol?L-1,c(Mg2+)=6×10-4mol·L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,水的硬度=![]()
![]()
=10°,属于硬水;
(3)聚丙烯酸钠的单体为丙烯钠,结构简式:CH2=CHCOONa;
(4)铝离子水解生成氢氧化铝和氢离子,离子方程式:Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,阴极是阳离子放电,所以隔膜B是阳离子交换膜;②根据阳极是氯离子放电:2Cl--2e-═Cl2↑,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大,和钙离子,镁离子形成沉淀。

 名校课堂系列答案
名校课堂系列答案