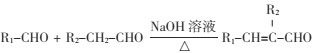题目内容
【题目】X、Y、Z、W、R是5种短周期元素,原子序数依次增大。已知X组成的单质是最理想的气体燃料,Y是形成化合物种类最多的元素,Z的原子最外层电子数是次外层电子数的3倍,W、R处于同一周期,W是该周期中金属性最强的元素,W与R能形成化合物WR.
请回答下列问题:
(1)Z在周期表中的位置是_________;R的原子结构示意图是_____________。
(2)工业上用化合物WR冶炼W的单质,若要得到2.3tW,至少需要WR的质量是_____。
(3)W与Z形成的化合物W2Z2可作供氧剂,该化合物含有的化学键类型有________________,其反应原理是_______________________________(用化学方程式表示)
(4)在一定条件下,R单质能与硫反应生成一种用途广泛的硫化剂S2R2;S2R2与足量水反应有黄色沉淀生成,同时生成能使品红溶液褪色的无色气体,则该反应的化学方程式是____________________。
【答案】 第二周期第VIA族 ![]() 5.85 t 离子键和共价键(或非极性共价键) 2Na2O2+2H2O=4NaOH+O2↑(或与CO2反应) 2S2Cl2+2H2O==3S↓+SO2↑+4HCl
5.85 t 离子键和共价键(或非极性共价键) 2Na2O2+2H2O=4NaOH+O2↑(或与CO2反应) 2S2Cl2+2H2O==3S↓+SO2↑+4HCl
【解析】X、Y、Z、W、R是5种短周期元素,原子序数依次增大。已知X组成的单质是最理想的气体燃料,则X为H;Y是形成化合物种类最多的元素,则Y为C元素;Z的原子最外层电子数是次外层电子数的3倍,则Z为O;W、R处于同一周期,W是该周期中金属性最强的元素,W与R能形成化合物WR,则W为Na,R为Cl,以此来解答。
根据以上分析可知X为H,Y为C,Z为O,W为Na,R为Cl,则
(1)Z为O,在周期表中的位置是第二周期第VIA族,R为Cl,原子结构示意图是![]() ;
;
(2)电解NaCl制备Na,由原子守恒可知需要NaCl为2.3t/23×58.5=5.85 t;
(3)W与Z形成的化合物Na2O2可作供氧剂,该化合物含有的化学键类型有离子键和共价键或非极性共价键,其反应原理是2Na2O2+2H2O=4NaOH+O2↑、2Na2O2+2CO2=2Na2CO3+O2;
(4)S2R2与足量水反应有黄色沉淀生成,同时生成能使品红溶液褪色的无色气体,则反应生成S、二氧化硫和HCl,该反应的化学方程式是2S2Cl2+2H2O=3S↓+SO2↑+4HCl。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案