题目内容
一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是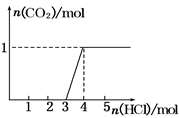
| A.通入的CO2气体为22.4 L |
| B.A溶液中n(NaOH)=2n(Na2CO3) |
| C.A溶液中既含Na2CO3,又含NaHCO3 |
| D.A溶液中一定只有Na2CO3 |
B
解析试题分析:A项:完全反应后, 生成的nCO2=" 1mol," 标准状况下="22.4L," 不可能大于. A不对;B项:显然, 开始时所用的CO2为1mol, ,NaHCO3 + HCl =" NaCl" + H2O + CO2↑,此反应消耗HCl 1mol (从nHCl = 3到nHCl =" 4" mol),之前消耗HCl 3mol,即使CO2与NaOH反应全部生成Na2CO3:Na2CO3 + HCl =" NaCl" + NaHCO3,此反应仅消耗HCl 1mol, 剩下的2mol HCl与NaOH反应. 所以,溶液A中有NaOH, 不可能有NaHCO3。HCl + NaOH =" NaCl" + H2O,即溶液A中有2mol NaOH, 1mol Na2CO3, B正确;C项:参见B, C不对;D项:C不对, 有NaOH和Na2CO3。故选B。
考点:钠的化合物的性质 化学计算

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温常压下,5.6L CH4含C—H键数目为NA |
| B.常温常压下,100g17%H2O2水溶液含氧原子总数为NA |
| C.标准状况下,5.6L O2与适量Na加热反应,转移电子数一定为NA |
| D.常温常压下,14g乙烯与丙烯的混合气体,含碳原子总数为NA |
设阿伏加德罗常数为NA,下列说法正确的是( )
| A.5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA |
| B.1 mol NH3含有的电子数10NA |
| C.常温常压下,22.4L的氧气含氧原子数为2NA |
| D.常温下,1L0.1mol/L AlCl3溶液中含Al3+数为0.1NA |
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
| A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA |
| B.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| C.在1 L 0.1 mol·L-1碳酸钠溶液中,阴离子总数大于0.1NA |
| D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
下列选项中所涉及到的两个量的一定相等的是
| A.11. 2LCl2与4.25gNH3所含有的原子数 |
| B.18.0g重水(D2O)与20gNe所含有的电子数 |
| C.标准状况下36gH2O与1.204×1024个O2分子所占的体积 |
| D.等物质的量的Al分别与足量的盐酸、NaOH溶液反应转移的电子数 |
将amol小苏打和bmol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1 mol,下列说法一定正确的是
| A.b=2 |
| B.容器中一定没有残余的CO2和水蒸气 |
| C.a:b≥1 |
| D.反应中转移的电子数一定为2NA |
下列说法正确的是
| A.含有相同氧原子数的SO2和CO的质量相等 |
| B.等物质的量浓度的NaOH溶液与氨水中的c(OH—)相等 |
| C.等物质的量的甲基(—CH3)与羟基(—OH)所含电子数相等 |
| D.等温等压下,2 mol O2(g)和l mol SO2(g)的密度相等 |
实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,请填空并回答下列问题:
(1)配制250mL 1.25mol/L的NaOH溶液
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
| | | |
A. 用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B. 用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C. 将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D. 将容量瓶盖紧,颠倒摇匀
E. 改用胶头滴管加水,使溶液凹面恰好与刻度相切
F. 继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 ;
(4)下列配制的溶液浓度偏低的是 ;
A. 称量NaOH时,砝码错放在左盘
B. 向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
C. 加蒸馏水时不慎超过了刻度线
D. 定容时俯视刻度线
E. 配制前,容量瓶中有少量蒸馏水