题目内容
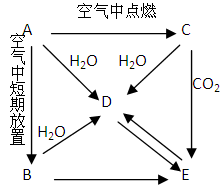
(8分)下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,D是应用最广泛的金属。根据图示回答问题:
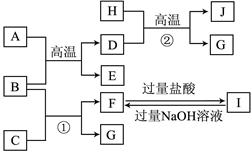
(1)反应②的化学方程式是 ;
(2)J与氢碘酸反应的离子方程式是 ;
(3)要使溶液F中的一种金属元素全部以沉淀的形式析出,最适宜加入的反应物是 (填化学式);I→F的离子方程式为 。

(1)反应②的化学方程式是 ;
(2)J与氢碘酸反应的离子方程式是 ;
(3)要使溶液F中的一种金属元素全部以沉淀的形式析出,最适宜加入的反应物是 (填化学式);I→F的离子方程式为 。
(1)3Fe + 4H2O(g) Fe3O4 + 4H2
Fe3O4 + 4H2
(2)Fe3O4 +2I-+8H+ === 3Fe2+ + I2 + 4H2O
(3)CO2 Al3+ + 4OH-=== AlO2-+ 2H2O
 Fe3O4 + 4H2
Fe3O4 + 4H2(2)Fe3O4 +2I-+8H+ === 3Fe2+ + I2 + 4H2O
(3)CO2 Al3+ + 4OH-=== AlO2-+ 2H2O
由题目所给信息可直接判定B为铝,它与A发生铝热反应得到应用最广泛的金属D为铁,同时得到E为氧化铝;
依据铁的性质可知在高温下它可和水蒸气反应生成J为Fe3O4 和G氢气;
铝与C置换出氢气G,同时得到F为偏铝酸盐,它与I之间可以通过加酸或加碱转化。
依据铁的性质可知在高温下它可和水蒸气反应生成J为Fe3O4 和G氢气;
铝与C置换出氢气G,同时得到F为偏铝酸盐,它与I之间可以通过加酸或加碱转化。

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目