题目内容
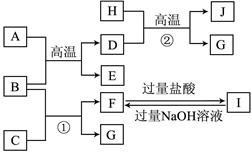
(7分)A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
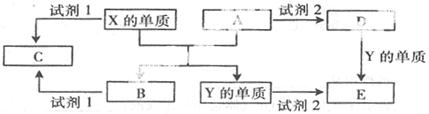
(1)X的单质与A反应的化学方程式是 。
(2)若试剂1是NaOH溶液。X的单质与试剂1反应的离子方程式是
。
(3)若试剂1和试剂2均是稀硫酸。
①将物质C溶于水,其溶液呈 性(填“酸”、“碱”或“中”)。
②某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式为

(1)X的单质与A反应的化学方程式是 。
(2)若试剂1是NaOH溶液。X的单质与试剂1反应的离子方程式是
。
(3)若试剂1和试剂2均是稀硫酸。
①将物质C溶于水,其溶液呈 性(填“酸”、“碱”或“中”)。
②某高效净水剂是由Y(OH)SO4聚合得到的,工业上以E、稀硫酸和亚硝酸钠(NaNO2)为原料制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式为
(1)2Al+Fe2O3 Al2O3+2Fe (2分)
Al2O3+2Fe (2分)
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑ (2分)
(3)① 酸 (1分)
②2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑(2分)
 Al2O3+2Fe (2分)
Al2O3+2Fe (2分)(2)2Al+2OH-+2H2O=2AlO2-+3H2↑ (2分)
(3)① 酸 (1分)
②2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑(2分)
本题是无机框图题,关键是找准突破点。元素X、Y的单质是生活中常见的金属,X能置换出Y,所以X是铝,Y是铁,则B是氧化铝,A是氧化铁。
(1)该反应是铝热反应,方程式是2Al+Fe2O3 Al2O3+2Fe。
Al2O3+2Fe。
(2)若试剂1是NaOH溶液。X的单质与试剂1反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。
(3)①若试剂1和试剂2均是稀硫酸,则C是硫酸铝,铝离子水解生成氢氧化铝和硫酸,所以溶液显酸性。
②E是硫酸亚铁,具有还原性。而亚硝酸钠具有氧化性,所以二者发生氧化还原反应,关键生成物可知,反应的方程式是2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑。
(1)该反应是铝热反应,方程式是2Al+Fe2O3
 Al2O3+2Fe。
Al2O3+2Fe。(2)若试剂1是NaOH溶液。X的单质与试剂1反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。
(3)①若试剂1和试剂2均是稀硫酸,则C是硫酸铝,铝离子水解生成氢氧化铝和硫酸,所以溶液显酸性。
②E是硫酸亚铁,具有还原性。而亚硝酸钠具有氧化性,所以二者发生氧化还原反应,关键生成物可知,反应的方程式是2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑。

练习册系列答案
相关题目