题目内容
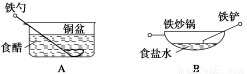
相同材质的铁在图中四种情况下最不易被腐蚀的是( )

C
【解析】在A中,能构成原电池,铁作负极,易被腐蚀;在B中,食盐水提供电解质溶液环境,铁炒锅和铁铲都是铁碳合金,符合原电池形成的条件,铁作负极,碳作正极,铁易被腐蚀;在C中,铜镀层将铁球覆盖,使铁被保护,所以铁不易被腐蚀;在D中,酸雨提供电解质溶液环境,铁铆钉和铜板分别作负、正极,形成原电池,铁易被腐蚀。

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
元素 代号 | A | B | D | E | G | H | I | J |
化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
A.I在DB2中燃烧生成两种化合物
B.A、H、J的离子半径由大到小顺序是H>J>A
C.G元素的单质不存在同素异形体
D.B和J能形成既含离子键又含共价键的化合物