��Ŀ����
����Ŀ��������Ѫ�쵰����Ҫ��ɳɷ֣�������������֯����O2�����ã����ȱ���Ϳ��ܳ���ȱ����ƶѪ�����������������Ҳ�к���������һ�ֳ�����ҩƷ˵�����еIJ������ݣ���ҩƷ��Fe2+33%��36%��������ˮ�������������е�θ���Vc��ά����C��ͬ�������ӱ�Ʒ���գ�
��1����һ����ͬѧ�����������ʵ����ò���ҩƷ���Ƿ���Fe2+��̽��Vc�����ã�
����������ˮ����Һ�з��������ӷ�Ӧ����ʽ����Fe3++SCN��[Fe��SCN��]2+ ��
��2������KSCN��Һ����Һ��Ϊ����ɫ��˵����Һ��������Fe3+ �� �����Ӵ��ڵ�ԭ������ǣ����ţ� ��
A.ҩƷ�е���������Ӧ��������������ʽ����
B.����ҩ��������������������
C.ҩƷ�������������������������
��3��ҩƷ˵�����С���Vcͬ�������ӱ�Ʒ���ա���˵������ ��
��4����������ͬѧ�����������������ø�����ر���Һ�ζ��ķ����ⶨ��ҩƷ�Ƿ�ϸ�Ӧԭ��Ϊ5Fe2++8H++MnO4��=5Fe3++Mn2++4H2O��ȷ��������ҩƷ10.00g������ȫ�������Լ�2�У��� �Ƴ�1000mL��Һ��ȡ��20.00mL����0.0200mol/L��KMnO4��Һ�ζ�����ȥKMnO4��Һ12.00mL�� ��ʵ���е��Լ�2���ͬѧ��Ƶ�ʵ���е��Լ�1��������������ţ���
A.����ˮ
B.ϡ����
C.ϡ����
D.ϡ����
��5����ʵ��ζ������в����ζ��ܵ�ͼʾ��ȷ�������ţ���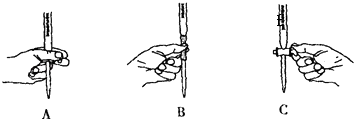
��6����ͨ�����㣬˵����ҩƷ�����������Ƿ�ϸ�д����Ҫ������̣���
���𰸡�
��1��2Fe2++Cl2=2Cl��+2Fe3+
��2��BC
��3��Fe2+������Ѫ�쵰��������O2�����ã�Fe3+û�д˹��ܣ�����Vc���ɷ�ֹҩƷ�е�Fe2+��������Fe3+���������ֻ������Fe2+ �� Fe2+������Ѫ�쵰��������O2�����ã�����Vc�ɷ�ֹҩƷ�е�Fe2+��������Fe3+��
��4��C
��5��A
��6���⣺�躬��������Ϊxmol����
5Fe2++8H++MnO4���T5Fe3++Mn2++4H2O
5 1
x 0.02mol��12��0.001L��
x=1.2��10��3mol��
1000mL��Һ��ȡ��20.00mL����ҩƷ�к�n��Fe2+��=0.0200mol/L��12.00��10��3L��5�� ![]() =0.0600mol��
=0.0600mol��
m��Fe2+��=0.0600mol��56g/mol=3.36g��
����������Ϊ�� ![]() ��100%=33.6%�����ĺ�����33%��36%��Χ�ڣ��ʺϸ�
��100%=33.6%�����ĺ�����33%��36%��Χ�ڣ��ʺϸ�
�𣺸�ҩƷ�ϸ�
���������⣺��1������������ˮ���������ӱ�����Ϊ�����ӣ����ӷ�ӦΪ2Fe2++Cl2=2Cl��+2Fe3+ �� ���Դ��ǣ�2Fe2++Cl2=2Cl��+2Fe3+����2�����������ױ�������������ҩ������������������������ҩƷ������������������������ɣ�
���Դ��ǣ�B��C����3��VcƬ���л�ԭ�ԣ��ܹ���ԭ�������������ɶ��������ӣ�Fe2+������Ѫ�쵰��������O2�����ã�Fe3+û�д˹��ܣ�����Vc�ɷ�ֹҩƷ�е�Fe2+��������Fe3+���������ֻ������Fe2+ �� Fe2+������Ѫ�쵰��������O2 �����ã�����Vc�ɷ�ֹҩƷ�е�Fe2+��������Fe3+����
���Դ��ǣ�Fe2+������Ѫ�쵰��������O2 �����ã�Fe3+û�д˹��ܣ�����Vc���ɷ�ֹҩƷ�е�Fe2+��������Fe3+���������ֻ������Fe2+ �� Fe2+������Ѫ�쵰��������O2 �����ã�����Vc�ɷ�ֹҩƷ�е�Fe2+��������Fe3+������4���Լ�1���ܽ����ã����ᡢϡ������ɣ����Լ�2���������ᣬ�ױ��������������Ӱ��ʵ��ⶨ�����ʵ���е��Լ�2���ͬѧ��Ƶ�ʵ���е��Լ�1��������ϡ���ᣬ
���Դ��ǣ�C����5��KMnO4��Һ����ʽ�ζ���ʢ�ţ��ζ�ʱ������ת������ֻ��ͼA���ϣ�
���Դ��ǣ�A��

 ��У����ϵ�д�
��У����ϵ�д�