题目内容
11.下列溶液中有关微粒的物质的量浓度关系正确的是( )| A. | pH=4的0.1 mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | NaHSO3和NaHCO3两溶液混合呈中性的溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+c(RO32-) | |
| C. | 常温下,等物质的量浓度的三种溶液:①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2中c(NH4+):①<③<② | |
| D. | 常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
分析 A.NaHA溶液显示酸性,说明HA-的电离程度大于其水解程度,则c(A2-)>c(H2A);
B.根据混合液中的电荷守恒分析;
C.碳酸根离子促进了铵根离子的水解,亚铁离子抑制了铵根离子的水解,水解程度越大,铵根离子浓度越小;
D.根据混合液中的电荷守恒、物料守恒判断.
解答 解:A.pH=4的0.1mol•L-1的NaHA溶液中,说明HA-的电离程度大于其水解程度,则c(A2-)>c(H2A),溶液中离子浓度大小为:c(HA-)>c(H+)>c(A2-)>c(H2A),故A错误;
B.NaHSO3和NaHCO3两溶液混合呈中性的溶液中(S和C均用R表示):c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(HRO3-)+2c(RO32-),故B错误;
C.常温下,等物质的量浓度的三种溶液:①(NH4)2CO3中碳酸根离子促进了铵根离子的水解②(NH4)2SO4溶液中铵根离子正常水解③(NH4)2Fe(SO4)2中亚铁离子抑制了铵根离子的水解,则溶液中c(NH4+)大小为:①<②<③,故C错误;
D.常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中,c(H+)=c(OH-),根据核电荷数可得:①c(Na+)=c(Cl-)+c(CH3COO-),则c(Na+)>c(Cl-);根据电荷守恒可得:②c(Na+)=c(CH3COO-)+c(CH3COOH),根据①②可得:c(Cl-)=c(CH3COOH),所以混合液中一定满足:c(Na+)>c(Cl-)=c(CH3COOH),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,试题涉及盐的水解原理及其影响、物料守恒、电荷守恒的含义及其应用,要求学生熟练掌握判断离子浓度大小常用方法,D为易错点,需要根据电荷守恒、物料守恒及溶液为中性方面分析.

 阅读快车系列答案
阅读快车系列答案| A. | 氧化还原反应前后元素化合价有升降 | |
| B. | 氧化还原反应前后一定有氧的得失 | |
| C. | 氧化还原反应前后一定有电子转移 | |
| D. | 复分解反应和化合反应一定是氧化还原反应 |
①该酸加热至沸腾也不分解
②该酸可溶解氢氧化铜
③该酸可跟石灰石反应放出CO2
④该酸是共价化合物.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | 都不是 |
| A. | NH4HCO3和NH4NO3 | B. | (NH4)2CO3和NH4Cl | C. | NH4Cl和NH4HCO3 | D. | NH4Cl和NH4NO3 |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 .
.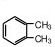 (结构简式)在苯环上的二溴代物只有两种.
(结构简式)在苯环上的二溴代物只有两种.