题目内容
2.(1)对不纯的固体有机物进行提纯常用的方法是重结晶法,测定未知纯净有机物相对分子质量的方法为质谱法.苯甲酸提纯实验时,加热使粗苯甲酸溶解后,再加入少量蒸馏水的目的是防止苯甲酸结晶析出_.(2)有机物由C、H、O三种元素组成,它的红外吸收光谱表明有羟基和烃基上的C-H键的红外吸收峰,且烃基与羟基上的氢原子个数之比为2:1,升温使其汽化,测其密度是相同条件下H2的31倍.该有机物的结构简式为HOCH2CH2OH_.
(3)写出CH3CCl=CHCH3这种烯烃的顺、反异构体的结构简式:
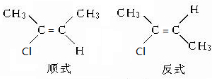 .
.(4)写出乙醇在浓硫酸的作用下,加热到170℃时发生的反应方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(5)某芳香烃的分子式为C8H10,它可能有的同分异构体共4种,其中
 (结构简式)在苯环上的二溴代物只有两种.
(结构简式)在苯环上的二溴代物只有两种.
分析 (1)实验室常用重结晶法提出固体有机物,用质谱法测定有机物相对分子质量,苯甲酸提纯实验时,加热使粗苯甲酸溶解后,再加入少量蒸馏水,防止晶体提前析出;
(2)设有机物分子中有n个O-H键,烃基和羟基上氢原子个数之比为2:1,则C-H键数为2n,其分子式为CxH3nOn(x、n均为正整数),则12x+19n=62,据此讨论确定该有机物的结构简式.同一碳原子上不能连有两个-OH;
(3)CH3CCl=CHCH3中C=C上的C原子连接不同的原子或原子团,存在顺反异构;
(4)乙醇在浓硫酸作用下加热到170°C生成乙烯和水;
(5)分子式为C8H10的芳香烃,分子中含有1个苯环,侧链为烷基,若有1个侧链,为-CH2-CH3;若有2个侧链,为-CH3,有邻、间、对三种,以此解答.
解答 解:(1)实验室常用重结晶法提出固体有机物,用质谱法测定有机物相对分子质量,苯甲酸提纯实验时,加热使粗苯甲酸溶解后,再加入少量蒸馏水,原因是因溶液过滤时溶液与环境的温差较大,易使苯甲酸晶体提前析出,滞留在过滤器中,故需在过滤前适当稀释,
故答案为:重结晶法;质谱法;防止苯甲酸结晶析出;
(2)密度是相同条件下H2的31倍,则相对原子质量为31×2=62,
设有机物分子中有n个O-H键,则C-H键数为2n,其分子式为CxH3nOn(x、n均为正整数)
则12x+19n=62
讨论:当n=1,x=3.58(不合理,舍去),
当n=2,x=2(合理),
有机物的分子式为C2H6O2,含有2个-OH,故结构简式为HOCH2CH2OH,
故答案为:HOCH2CH2OH;
(3)CH3CCl=CHCH3中C=C上的C原子连接不同的原子或原子团,存在顺反异构,为 ,
,
故答案为: ;
;
(4)乙醇与浓硫酸混合加热到170℃发生消去反应生成乙烯,反应的化学方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(5)分子式为C8H10的芳香烃,分子中含有1个苯环,侧链为烷基,若有1个侧链,为-CH2-CH3,有一种;若有2个侧链,为-CH3,有邻、间、对三种,故符合条件的结构共有4种,
乙苯 苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种;
苯环上有3种不同氢原子,所以苯环上的一溴取代物有3种;
邻二甲苯 的苯环上有2种不同氢原子,所以苯环上的一溴取代物有2种;
的苯环上有2种不同氢原子,所以苯环上的一溴取代物有2种;
对二甲苯 的苯环上有1种不同氢原子,所以苯环上的一溴取代物只有1种;
的苯环上有1种不同氢原子,所以苯环上的一溴取代物只有1种;
间二甲苯 的苯环上只有3种氢原子,所以苯环上的一溴取代物有3种;
的苯环上只有3种氢原子,所以苯环上的一溴取代物有3种;
故答案为:4; .
.
点评 本题考查较为综合,涉及有机物的检验、及分子式的计算以及同分异构体的判断等知识,为高频考点,注意把握同分异构体的判断,为本题的易错点,难度中等.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | CH3CH2OH(CH3COOH) | CaO | 蒸馏 |
| D | CO2(SO2) | Na2CO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  与 与 | B. | CH3-CH=CH2与 | ||
| C. | CH3-O-CH3和CH3CH2OH | D. | 正戊烷和异戊烷 |
| A. | 构成水的氢气和氧气都是可燃物,因此可研究在水不分解的情况下,使氢气成为二级能源 | |
| B. | 使太阳能聚焦,产生高温,使水分解生成氢气和氧气 | |
| C. | 研究特殊化学物质,开发廉价能源以分解水制取氢气 | |
| D. | 研究高效催化剂,使水分解产生氢气,同时释放能量 |
| A. | 丙烯 | B. | 乙炔 | C. | 甲苯 | D. | 甲烷 |
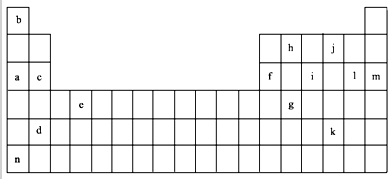
(1)上述元素的单质可能是电的良导体的是acdefhn(填字母代号).
(2)表中是一些气态基态原子的第一、二、三、四级电离能(kJ•mol-1):
| 锂 | X | Y | |
| 第一电离能 | 519 | 502 | 580 |
| 第二电离能 | 7296 | 4570 | 1820 |
| 第三电离能 | 11799 | 6920 | 2750 |
| 第四电离能 | 9550 | 11600 |
②表中Y可能为以上13种元素中的Al(填元素符号)元素.用元素符号表示X和j按原子个数1:1形成化合物的电子式
 .
.(3)根据构造原理,用电子排布式表示e的核外电子排布式1s22s22p63s23p63d24s2.
(4)以上13种元素中,Ar(填元素符号)元素原子失去核外第一个电子需要的能量最多.
(5)a、c、f三种元素的最高价氧化物的水化物显碱性,其碱性强弱为NaOH>Mg(OH)2>Al(OH)3(用化学符号作答),f的氧化物具有两性,写出其与NaOH溶液反应的离子方程式2OH-+Al2O3=AlO2-+2H2O.
| A. | 放热反应的反应物总能量,高于生成物的总能量 | |
| B. | 需加热或点燃才发生的反应必为吸热反应 | |
| C. | 酸与碱的中和反应是放热反应 | |
| D. | 焦炭在高温下与水蒸气的反应是吸热反应 |
| A. | 沸点:HI>HBr>HCl>HF | |
| B. | 稳定性:NH3>PH3>AsH3(As与N位于同一主族) | |
| C. | 酸性:HClO4>H2SO4>H3PO4 | |
| D. | 碱性:NaOH>Mg(OH)2>Be(OH)2 |
| A. | pH=4的0.1 mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | NaHSO3和NaHCO3两溶液混合呈中性的溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+c(RO32-) | |
| C. | 常温下,等物质的量浓度的三种溶液:①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2中c(NH4+):①<③<② | |
| D. | 常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |