题目内容
6.将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$的值与温度高低有关.当n(KOH)=a mol时,下列有关说法不正确的是( )| A. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| B. | 改变温度,产物中KC1O3的最大理论产量为1/7amol | |
| C. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=$\frac{1}{2}$ | |
| D. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$amol≤ne≤$\frac{5}{6}$amol |
分析 A.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),据此计算判断;
B.氧化产物只有KClO3时,其物质的量最大,结合C中计算判断;
C.设n(ClO-)=1mol,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则n(Cl-)=11mol,根据电子转移守恒计算n(ClO3-);
D.氧化产物只有KClO3时,转移电子最多,氧化产物只有KClO时,转移电子最少,根据电子转移守恒及钾离子守恒计算.
解答 解:A.由Cl原子守恒可知,2n(Cl2)=n(KCl)+n(KClO)+n(KClO3),由钾离子守恒可知n(KCl)+n(KClO)+n(KClO3)=n(KOH),故参加反应的氯气的物质的量为:n(Cl2)=$\frac{1}{2}$n(KOH)=0.5a mol,故A正确;
B.氧化产物只有KClO3时,其物质的量最大,则n最大(KClO3)=$\frac{1}{6}$n(KOH)=$\frac{1}{6}$a mol,故B错误;
C.设n(ClO-)=1mol,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则n(Cl-)=11mol,电子转移守恒,5×n(ClO3-)+1×n(ClO-)=1×n(Cl-),即:5×n(ClO3-)+1×1mol=1×11mol,解得:n(ClO3-)=2mol,故溶液中$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=$\frac{1}{2}$,故C正确;
D.氧化产物只有KClO3时,转移电子最多,根据电子转移守恒n(KCl)=5(KClO3),由钾离子守恒:n(KCl)+n(KClO3)=n(KOH),故n(KClO3)=$\frac{1}{6}$n(KOH)=$\frac{1}{6}$a mol,转移电子最大物质的量为:$\frac{1}{6}$a mol×5=$\frac{5}{6}$a mol,氧化产物只有KClO时,转移电子最少,根据电子转移守恒n(KCl)=n(KClO),根据钾离子守恒:n(KCl)+n(KClO)=n(KOH),故:n(KClO)=$\frac{1}{2}$n(KOH)=$\frac{1}{2}$a mol,转移电子最小物质的量=$\frac{1}{2}$a mol×1=$\frac{1}{2}$a mol,则反应中转移电子的物质的量ne的范围为:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol,故D正确;
故选B.
点评 本题考查氧化还原反应计算,题目难度中等,注意电子转移守恒及极限法的应用,试题培养了学生的分析、理解能力及化学计算能力.

| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+=2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-=CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(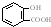 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: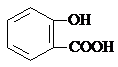 +HCO3-→ +HCO3-→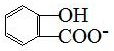 +CO2↑+H2O +CO2↑+H2O |

(a、b、c均大于零)下列说法正确的是( )
| A. | H2、I2和HI都是共价化合物 | |
| B. | 断开2 mol HI分子中的化学键所需能量约为(c+b+2a) kJ | |
| C. | 相同条件下,1 mol H2(g)和1mol I2(g)总能量小于2 mol HI (g)的总能量 | |
| D. | 向密闭容器中加入1 mol H2(g)和1 mol I2(g),充分反应后放出的热量为2a kJ |
| A. | 苯在常温下可与溴水发生取代反应 | |
| B. | 糖类、油脂和蛋白质都能发生水解反应 | |
| C. | 乙醇和乙酸都能与金属钠反应 | |
| D. | 葡萄糖能发生氧化反应和银镜反应 |
| A. | 平行光照射胶体产生丁达尔现象 | B. | 紫外线照射下,液态蛋白质凝固 | ||
| C. | 电解质溶液导电过程 | D. | 铁遇到冷的浓硝酸溶液发生钝化 |
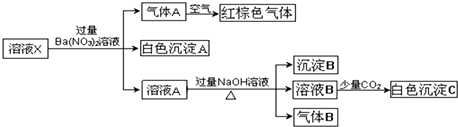
| A. | 原溶液中可能含有NO3-和Al3+ | |
| B. | 白色沉淀C可能是Al(OH)3 | |
| C. | 原溶液中一定存在NH4+、Fe2+、SO42-、Cl- | |
| D. | 沉淀B可能是Fe(OH)2和Fe(OH)3的混合物 |
| A. | “镉大米”、“血铅”中所含的重金属单质能使蛋白质发生变性 | |
| B. | 雾霾是指水汽、烟尘等悬浮在大气中的对健康无害的气溶胶 | |
| C. | 停止使用氟氯代烷(氟利昂)是为了有效控制“温室效应” | |
| D. | 开发和生产无汞电池,可大幅度降低电池对土壤、水源的污染 |
| A. | 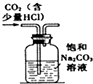 图装置:除去二氧化碳中的少量氯化氢气体 | |
| B. | 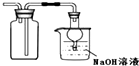 图装置:收集二氧化硫并吸收尾气 | |
| C. |  图装置:用酸性高锰酸钾溶液滴定过氧化氢溶液 | |
| D. |  图装置:用水吸收氯化氢气体并防止倒吸 |
| A. | 25℃时,pH=4的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| B. | 25℃时,pH=3的氯化铵溶液中:c(OH-)=1.0×10-3mol•L-1 | |
| C. | 将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |