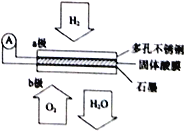
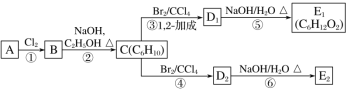
题目内容
【题目】一定温度下,下列叙述是可逆反应N2(g)+3H2(g)![]() 2NH3(g),在定容密闭容器中达到平衡的标志的是 ( )
2NH3(g),在定容密闭容器中达到平衡的标志的是 ( )
①NH3的生成速率与NH3的分解速率相等;
②单位时间内amolN2生成,同时生成3amolH2;
③N2的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦N2、H2、NH3的分子数目比为1:3:2;
A.②⑤ B.①③④⑤ C.②⑥⑦ D.⑤⑥
【答案】B
【解析】
试题分析:①NH3的生成速率与NH3的分解速率相等,即正逆反应速率相等,达到平衡状态,①正确;②单位时间内amolN2生成,同时生成3amolH2只能说明单方向N2、H2关系,不能说明正逆反应速率的关系,②错误;③N2的浓度不再变化,说明达到了平衡状态,③正确;④因该反应是物质的量在减少的化学反应,物质的量与压强成正比,则混合气体的压强不随时间的变化而变化,达到平衡状态,④正确;⑤混合气体的平均摩尔质量=![]() ,质量是守恒的,物质的量只有达到平衡时才不变,当混合气体的平均摩尔质量不再变化,证明达到了平衡状态,⑤正确;⑥用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2是反应进行到任何时刻都成立的关系,不能说明达到了平衡,⑥错误;⑦N2、H2、NH3的分子数目比为1:3:2不是平衡的判据,⑦错误;答案选B。
,质量是守恒的,物质的量只有达到平衡时才不变,当混合气体的平均摩尔质量不再变化,证明达到了平衡状态,⑤正确;⑥用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2是反应进行到任何时刻都成立的关系,不能说明达到了平衡,⑥错误;⑦N2、H2、NH3的分子数目比为1:3:2不是平衡的判据,⑦错误;答案选B。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】(1)氨气还原氮氧化物的反应为:
①N2(g)+O2(g)=2NO(g) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=___。(用含△H1、△H2的式子表示)
依据反应②,将氨气设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____。
(2)一定温度下,向2L恒容密闭容器中充4.0molNO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)N2(g)+4CO2(g) △H<0,测得相关数据如表:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/molL1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/molL1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①05min,用NO2的浓度变化表示的反应速率为______。
②以下表述能说明该反应己达到平衡状态的是_____。
A.2v(NO2)正=v(N2)逆 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.N2与CO2的物质的量之比保持不变
③20min时,保持温度不变,继续向该容器中加入1.0molNO2和1.0molCO,反应再次达到平衡时,NO2的转化率比原平衡___(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K=____。
(3)湿法脱硝:采用NaClO2溶液作为吸收剂可对烟气进行脱硝。323K下,向足量碱性NaClO2溶液中通入含NO的烟气,充分反应后,溶液中离子浓度的分析结果如表:
离子 | NO3 | NO2 | Cl |
c/(molL1) | 2.0×104 | 1.0×104 | 1.75×104 |
①NaClO2溶液显碱性,用离子方程式解释原因_____。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式_____
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中均发生反应:![]()
![]() 实验测得有关数据如下表所示:
实验测得有关数据如下表所示:
容器编号 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化/kJ | ||
|
|
| ||
甲 | 2 | 1 | 0 |
|
乙 | 1.8 | 0.9 | 0.2 |
|
丙 | 0 | 0 | 2 |
|
下列判断中正确的是( )
A.![]()
B.若升高温度,反应的热效应不变
C.![]()
D.生成![]() 时放出的热量大于98.5 kJ
时放出的热量大于98.5 kJ