题目内容
【题目】除去Na2CO3固体中的NaHCO3,最合适的试剂或方法是
A.H2SO4B.NaOHC.加热D.通入CO2
【答案】C
【解析】
A.硫酸和碳酸钠、碳酸氢钠均可以反应,故A错误;
B.若加入过量的氢氧化钠,会引入新的杂质,则B错误;
C.加热可使碳酸氢钠分解,生成碳酸钠、水和二氧化碳,故C正确;
D.通入二氧化碳,碳酸钠会反应生成碳酸氢钠,达不到除杂的效果,故D错误;
答案选C。

 阶梯计算系列答案
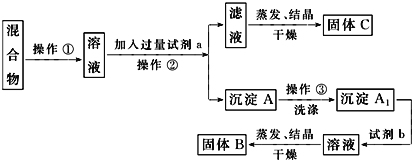
阶梯计算系列答案【题目】某地湖盐中含有Ca2+、Mg2+、Fe3+、SO42-等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:

(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是____________________________。
(2)过程Ⅱ的目的是除去SO42-,加入的X溶液是________________________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/(100gH2O):
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
①过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3外还有_______________________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为_________________________________。
(4)上述精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,除去这些离子及进行电解的流程如下:
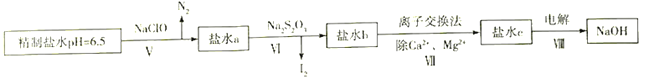
①过程Ⅴ生成N2的离子方程式为__________________________________。
②过程Ⅵ可以通过控制Na2S2O3的量,将IO3-还原为I2,且盐水b中含有SO42-,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为________________________________。
③在过程Ⅳ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O。为了测定其含Na2S2O3·5H2O的纯度,称取8.00 g样品,配成250 mL溶液,取25.00 mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.050 0 mol·L-1的碘水滴定(发生反应2S2O32-+I2==S4O62-+2I-),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为________________________________。