题目内容
【题目】某地湖盐中含有Ca2+、Mg2+、Fe3+、SO42-等杂质离子,氨碱厂用该地湖盐制取烧碱。其中制得精制食盐水的过程如下:

(1)过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是____________________________。
(2)过程Ⅱ的目的是除去SO42-,加入的X溶液是________________________。
(3)下表是过程Ⅱ、Ⅲ中生成的部分沉淀及其在20℃时的溶解度[g/(100gH2O):
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
①过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3外还有_______________________。
②过程Ⅳ中调节pH时发生的主要反应的离子方程式为_________________________________。
(4)上述精制食盐水中还含有微量的I-、IO3-、NH4+、Ca2+、Mg2+,除去这些离子及进行电解的流程如下:
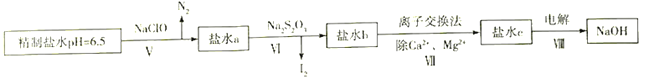
①过程Ⅴ生成N2的离子方程式为__________________________________。
②过程Ⅵ可以通过控制Na2S2O3的量,将IO3-还原为I2,且盐水b中含有SO42-,该过程中发生氧化还原反应,其中氧化剂和还原剂的物质的量之比为________________________________。
③在过程Ⅳ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O。为了测定其含Na2S2O3·5H2O的纯度,称取8.00 g样品,配成250 mL溶液,取25.00 mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.050 0 mol·L-1的碘水滴定(发生反应2S2O32-+I2==S4O62-+2I-),下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
第一次 | 0.30 | 29.12 |
第二次 | 0.36 | 30.56 |
第三次 | 1.10 | 29.88 |
计算样品的纯度为________________________________。
【答案】 加快物质溶解 BaCl2溶液 BaCO3、Mg2(OH)2CO3 CO32-+2H+=CO2↑+H2O 2NH4++3ClO-==N2↑+3Cl-+2H++3H2O 8.5 89.28%
【解析】(1)因为溶解需要吸热,过程Ⅰ中将粗盐加水溶解需要适当加热,其目的是加快物质溶解。
(2)因为SO42-+Ba2+= BaSO4难溶于水和酸的沉淀,所以过程Ⅱ是除去SO42-,需加入BaCl2溶液。
(3)①过程II剩余的滤液中含有的阳离子为Ca2+、Mg2+、Fe3+ Ba2+离子,加Na2CO3
后,过程Ⅲ中生成的主要沉淀除CaCO3和Fe(OH)3 BaCO3、Mg2(OH)2CO3。答案:BaCO3、Mg2(OH)2CO3。
②过程Ⅲ滤液中含有CO32-, 过程Ⅳ中调节pH时发生的主要反应的离子方程式为CO32-+2H+=CO2↑+H2O。
(4)由图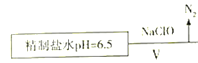 ①过程Ⅴ生成N2的离子方程式为2NH4++3ClO-==N2↑+3Cl-+2H++3H2O
①过程Ⅴ生成N2的离子方程式为2NH4++3ClO-==N2↑+3Cl-+2H++3H2O
②过程VI可以通过控制Na2S2O3的量,将IO3-还原为I2,且盐水b中含有SO42-,该过程中发生氧化还原反应为:5S2O32-+ 8IO3-+ H2O=5 I2+ 10SO42-+ 2H+氧化剂和还原剂的物质的量之比为8:5。
③根据题中表中的数据可知,第二次数据偏差较大,所以取一、三两次实验的数据,所以用去的碘水的体积为(28.82+28.78)/2mL=28.8mL,碘的物质的量为:0.0500molL-l×0.0288L=0.00144mol,
2S2O32-+I2═S4O62-+2I-,
2 1
x 0.00144mol
解x=0.00288mol,故Na2S2O35H2O的物质的量为0.00288mol,质量为:0.00288×248g/mol=0.714g,则称取8.0g产品,配制成250mL溶液中,Na2S2O35H2O的质量为=0.714g×250/25=7.14g。故产品的纯度为:7.14/8.0×100%=89.28%

【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
【题目】I.下列是A、B、C、D、E五种短周期元素的某些性质:
性质 | A | B | C | D | E |
化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
(1)元素A是形成有机物的主要元素,下列分子中存在sp和sp3杂化方式的是____(填序号)。
a.![]() b.CH4 c.CH2
b.CH4 c.CH2![]() CHCH3d.CH3CH2C≡CH e.CH3CH3
CHCH3d.CH3CH2C≡CH e.CH3CH3
(2)相同条件下,AD2与BD2分子在水中的溶解度较大的是_______(写化学式)
(3)B、D形成的简单氢化物,沸点:_______更高(写化学式)
II.乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图所示装置制备乙酸乙酯。

(1)若实验中用乙酸和乙醇反应,则该装置与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是_______。
(2)若现有乙酸90 g,乙醇138 g,发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为__。
(3)用如图所示的分离操作流程分离含乙酸、乙醇和水的乙酸乙酯粗产品,图中( )内为适当的试剂,[ ]内为适当的分离方法。

试剂a是____;分离方法③是____。