题目内容
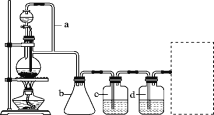
【题目】(1)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
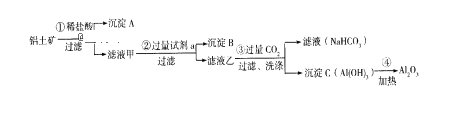
①沉淀A、B的成分分别是______、______;步骤②中的试剂a是_____;(以上均填化学式)。
②试写出步骤③中生成沉淀C的离子方程式________________;
③简述检验所得滤液甲中存在Fe3+的操作方法:______________。
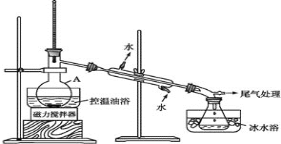
(2)用含少量铁的氧化铜制取氯化铜晶体(CuCl2xH2O)。有如下操作:
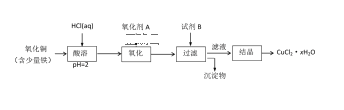
已知:在pH为4~5时,Fe3+几乎完全转化为Fe(OH)3沉淀,Cu2+却不反应。
①试剂B可选用______(填编号)。
A.NaOH溶液 B.CuO C.浓氨水 D.Cu2(OH)2CO3
②若氧化剂A是H2O2溶液,写出加入氧化剂A发生反应的离子方程式________
③从滤液经过结晶得到氯化铜晶体的方法是________
【答案】SiO2 Fe(OH)3 NaOH CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3- 取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+ BD 2Fe2++2H2O2+2H+=2Fe3++2H2O 蒸发浓缩、冷却结晶、(过滤)
【解析】
(1)根据流程图,铝土矿加入稀盐酸,Al2O3、Fe2O3能与盐酸反应生成氯化铝和氯化铁, SiO2与盐酸不反应,过滤得沉淀SiO2;滤液甲中含有氯化铝和氯化铁,滤液甲加入过量的氢氧化钠溶液,氯化铝与氢氧化钠反应生成偏铝酸钠和水、氯化铁与氢氧化钠反应生成氢氧化铁沉淀,过滤得沉淀氢氧化铁;滤液乙中含有偏铝酸钠,向偏铝酸钠溶液中通入过量的二氧化碳气体,生成氢氧化铝沉淀和碳酸氢钠。氢氧化铝加热分解为氧化铝。
(2)含少量铁的氧化铜加入盐酸,生成氯化亚铁和氯化铁溶液;溶液中通入氯气把氯化亚铁氧化为氯化铁,加入试B调节pH为4~5,Fe3+完全转化为Fe(OH)3沉淀,过滤得氯化铜溶液,在氯化氢气流中蒸发溶液得氯化铜晶体。
(1)①根据以上分析,铝土矿中SiO2与盐酸不反应,所以沉淀甲是SiO2;滤液甲加入过量的氢氧化钠溶液,氯化铁与过量氢氧化钠反应生成氢氧化铁沉淀,沉淀乙是Fe(OH)3;根据氢氧化铝溶于强碱,所以步骤②中的试剂a是NaOH;
②步骤③中偏铝酸钠溶液与过量的二氧化碳气体反应,生成氢氧化铝沉淀和碳酸氢钠,反应离子方程式是CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3-;
③Fe3+遇KSCN溶液变红,所以检验所得滤液甲中存在Fe3+的操作是:取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+;
(2)①加入试剂B的目的是调节pH为4~5除去氯化铜中Fe3+; A.加入NaOH溶液,引入杂质离子Na+ B.加入CuO能消耗氢离子,使pH升高,不引入杂质离子; C.加入浓氨水,引入杂质离子NH4+;D.加入 Cu2(OH)2CO3能消耗氢离子,使pH升高,不引入杂质离子,故选BD;
②若氧化剂A是H2O2溶液,H2O2把Fe2+氧化为Fe3+,发生反应的离子方程式是2Fe2++2H2O2+2H+=2Fe3++2H2O;
③从滤液经过结晶得到氯化铜晶体,首先要加热蒸发浓缩,冷却结晶,再过滤即可。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)③、④、⑧的原子半径由大到小的顺序为:______(用元素符号回答)。
(2)⑤、⑥、⑦的最高价氧化物对应的水化物碱性由强到弱的顺序是:______。(用化学式回答)
(3)②和⑨两种元素成的某化合物是一种常见的有机溶剂,则该化合物的电子式为:______ 。
(4)④和⑧形成的化合物属于______晶体(填“离子”、“分子”、“原子”),该晶体中微粒间的作用力为:______。
(5)②形成的单质与③形成的最高价氧化物的水化物的浓溶液发生化学反应的方程式为:________。