题目内容
某元素R,其原子最外层比次外层多一个电子,则其含氧酸的化学式不可能是
| A.HRO2 |
| B.H3RO3 |
| C.H2RO4 |
| D.H2R4O7 |
C
最外层比次外层多1个电子,R只能是硼(B): ,在含氧酸中最高价为+3价,
,在含氧酸中最高价为+3价, ,
, ,
,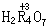 均可能,而H2RO4不可能。
均可能,而H2RO4不可能。
 ,在含氧酸中最高价为+3价,
,在含氧酸中最高价为+3价, ,
, ,
,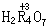 均可能,而H2RO4不可能。
均可能,而H2RO4不可能。
练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目