题目内容
【题目】现有短周期主族元素X,Y,Z,R,T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族.五种元素原子半径与原子序数之间的关系如图所示.下列推断正确的是( ) 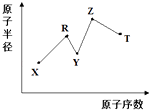
A.离子半径:Y<Z
B.氢化物的沸点:Y<T
C.最高价氧化物对应水化物的酸性:T<R
D.由X,Y,Z,R四种元素组成的常见化合物中含有离子键
【答案】D
【解析】解:短周期主族元素中,R原子最外层电子数是电子层数的2倍,可能为C或S,由图中原子半径和原子序数关系可知R应为C;Y与Z能形成Z2Y、Z2Y2型离子化合物,应为Na2O、Na2O2 , 则Y为O,Z为Na;Y与T同主族,则T应为S,X的原子半径最小,原子序数最小,则X为H元素.
A.离子电子层结构相同,核电荷数越大离子半径越小,则离子半径O2﹣>Na+ , 故A错误;
B.非金属性O>S,故氢化物稳定性:H2O>H2S,故B错误;
C.非金属性S>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C错误;
D.由H、O、Na、C四种元素组成的化合物为NaHCO3等,含有离子键,故D正确.
故选D.

【题目】在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下[2NO2(g)![]() N2O4(g) △H<0]:
N2O4(g) △H<0]:
容器 | 物质 | 起始浓度/(mol | 平衡浓度/(mol |
Ⅰ | N2O4 | 0.100 | 0.040 |
NO2 | 0 | 0.120 | |
Ⅱ | N2O4 | 0 | 0.0142 |
NO2 | 0.100 | 0.0716 |
下列说法不正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应的转化率a(N2O4)>a(NO2)
B. 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ)
C. 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(I)=![]()
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深