题目内容
20.对于任意反应,决定化学反应速率的最主要因素是( )| A. | 反应物浓度 | B. | 温度 | C. | 压强 | D. | 反应物本身性质 |
分析 影响化学反应速率的因素很多,物质本身的性质是决定性的因素,温度、压强、浓度、催化剂、固体表面积是外界因素.
解答 解:影响化学反应速率的因素中,反应物本身性质是决定性的因素,即最主要因素,而温度、压强、浓度、催化剂、固体表面积是外界因素是次要因素.
故选D.
点评 本题考查学生影响化学反应速率的因素,注意反应物的结构与性质是决定性的因素这一点是关键,难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
10.现有短周期元素X、Y、Z、M,X、Y位于同主族,Z、M位于同主族,Y、Z位于同周期,X与Z、M都不在同一周期,Z的核电荷数是M的2倍.下列说法正确的是( )
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z>M | |
| C. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| D. | X2Z与X2M比较,稳定性:X2Z>X2M |
11.反应4NH3+5O2=4NO+6H2O在5L的密闭容器中进行,30s后,NO的物质的量增加了0.3mol,则此反应的化学反应速率为( )
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.008mol/(L•s) | ||
| C. | v(H2O)=0.001mol/(L•s) | D. | v(NH3)=0.002mol/(L•s) |
8.室温下,同种规格的铝片分别与下列物质混合,产生氢气速率最大的是( )
| A. | 0.1 mol/L的盐酸15mL | B. | 0.15 mol/L 的硫酸溶液8mL | ||
| C. | 0.2 mol/L 的盐酸12mL | D. | 18 mol/L的浓硫酸15mL |
15. 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC>Si; SiCl4<SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?不能(填“能”或“不能”),原因是物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低
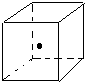
(3)如图立方体中心的“•”表示金刚石晶体中的一个原子,请在立方体的顶点用“•”表示出与之紧邻的碳原子
(4)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$ Si(s)+4HCl(g)计算该反应的反应热△H为+236kJ/mol.
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
SiC>Si; SiCl4<SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?不能(填“能”或“不能”),原因是物质熔点高低由构成物质的微粒间作用力决定,单质Si属于原子晶体,原子间作用力是共价键;SiCl4属于分子晶体,分子间作用力是范德华力,比共价键弱得多.因此不能都根据键能来判断物质的熔点高低
(3)如图立方体中心的“•”表示金刚石晶体中的一个原子,请在立方体的顶点用“•”表示出与之紧邻的碳原子
(4)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$ Si(s)+4HCl(g)计算该反应的反应热△H为+236kJ/mol.
9.下列事件处理中,不正确的是( )
| A. | 用福尔马林保存生物标本 | |
| B. | 试管上沾有苯酚时,用水洗 | |
| C. | 实验室不慎将Hg洒在地上时,立即用硫粉覆盖 | |
| D. | 皮肤上沾有苯酚时,立即用酒精擦洗 |
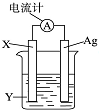 依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag++Cu═Cu2++2Ag设计的原电池如图所示.请回答下列问题:
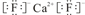 ;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式).
;该离子化合物晶体的密度为ag•cm-3.,则晶胞的体积是$\frac{\frac{78}{{N}_{A}}×4}{a}$(只要求列出算式).