题目内容
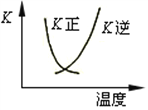
【题目】合成氨反应N2(g)+3H2(g)![]() 2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。

请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变_____(填“大”或“小”),E的大小对该反应的反应热有无影响?________。
(2)起始充入2mol·L-1 N2和5.5 mol·L-1 H2 ,经过50 min,NH3的浓度为1mol·L-1,则v(N2)=_____。
(3)已知NH3(g)= NH3 (l) ΔH=-Q kJ·mol-1,则N2(g)+3H2(g)= 2NH3 (l)的H=_________。
【答案】 小 无 0.01mol·L-1·min-1 (-92.2-2Q)kJ·mol-1
【解析】试题分析:由图像可知,合成氨反应N2(g)+3H2(g)![]() 2NH3(g)是一个放热反应。
2NH3(g)是一个放热反应。
(1)该反应通常用铁作催化剂,加催化剂可以降低反应的活化能,所以E变小,E的大小对该反应的反应热没有影响,因为正反应和逆反应的活化能减小的程度是相同的。
(2)起始充入2mol·L-1 N2和5.5 mol·L-1 H2 ,经过50 min,NH3的浓度为1mol·L-1,则氮气的变化量为0.5 mol·L-1,v(N2)=![]() 0.01mol·L-1·min-1。
0.01mol·L-1·min-1。
(3)已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量,所以生成2mol NH3(g),放出92.2 kJ的热量,NH3(g)= NH3 (l) ΔH=-Q kJ·mol-1,则N2(g)+3H2(g)= 2NH3 (l)的H=(-92.2-2Q)kJ·mol-1。

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目