题目内容
【题目】下列叙述正确的是

A. pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同
B. 2SO2(g) + O2(g)![]() 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示
2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示
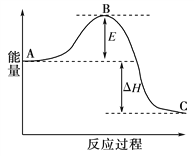
C. 2NO+2CO![]() 2CO2+N2 的ΔH<0,常温下该反应一定能自发进行
2CO2+N2 的ΔH<0,常温下该反应一定能自发进行
D. 25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
【答案】B
【解析】试题分析:A、醋酸抑制水的电离,氯化铵水解促进水的电离,故A错误;B、正反应为放热反应,温度升高平衡向逆反应方向移动,正反应的平衡常数减小,逆反应的平衡常数增大,故B正确;C、该反应是气体系数和减小的反应,故ΔS<0,ΔH—TΔS不一定小于0,故C错误;D、铵根离子结合氢氧化镁电离生成的氢氧根离子,使氢氧根离子的浓度减小,电离平衡向右移动,镁离子的浓度增大,故D错误;故选B。

练习册系列答案
相关题目