题目内容
【题目】现有A、B、X、Y、Z五种短周期元素,原子序数逐渐增大。它们的性质或原子结构如表:
元素 | 性质或原子结构 |
A | 原子核内只有一个质子 |
B | 单质是空气中含最多的气体 |
X | 原子的最外层电子数是次外层电子数的3倍 |
Y | 短周期元素中原子半径最大的元素(除稀有气体外) |
Z | 最高正化合价与最低负化合物的代数和为6 |
(1)X的元素名称及在元素周期表中的位置:___、___。
(2)B、X、Y的原子半径由大到小的顺序为(用元素符号表示)___。
(3)W元素的核电荷数是B、X的核电荷数的和,则W与Z的氢化物稳定性为___>___(填化学式)。
(4)A、X两元素形成的原子个数比为2:1的化合物属于___晶体,写出该晶体与Z元素形成的单质反应的化学方程式___。
【答案】氧 第二周期第VIA族 Na>N>O HCl PH3 分子 Cl2+H2O ![]() HCl+HClO
HCl+HClO
【解析】
A、B、 X、Y、Z五种短周期元素,原子序数逐渐增大,A元素原子核内只有一个质子,则A为H元素;B单质是空气中含最多的气体,则B为N元素;X原子的最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;Y是短周期元素中原子半径最大的元素(除稀有气体外),则Y为Na元素;Z最高正化合价与最低负化合物的代数和为6,最高正化合价为+7,原子序数最大,故Z为Cl元素。
(1)由分析可知,X元素名称为氧,位于周期表中第二周期第VIA族;
(2)同周期自左而右原子半径依次减小,同主族自上而下原子半径依次增大,故原子半径:Na>N>O;
(3)W元素的核电荷数是N(核电荷数为7)、O(核电荷数为8)的核电荷数的和,则W(核电荷数为15)为P,非金属性P< Cl,故氢化物稳定性HCl> PH3;
(4)H、O两元素形成的原子个数比为2: 1的化合物H2O,属于分子晶体,H2O与Z元素形成的单质(Cl2)反应的化学方程式:Cl2+H2O ![]() HCl+HClO;
HCl+HClO;

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】(一)(1)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g) + I2(g)。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k正为________(以K和k逆表示)。若k正= 0.0027min-1,在t=40min时,v正=________min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)。
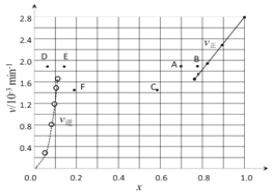
(二)常温下,将0.01 mol·L-1的Ba(OH)2溶液200mL和0.01 mol·L-1的NaHSO4溶液100mL混合,反应后溶液的pH值为______________________。