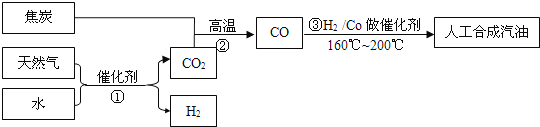
ЬтФПФкШн
ЁОЬтФПЁПвбжЊЃКCOКЭH2дкCoзіДпЛЏМСЁЂЮТЖШЮЊ160ЁцЁЋ200ЁцЪБЃЌПЩвдКЯГЩЦћгЭЃЈМДЗжзгжаКЌ5жС8ИіЬМдзгЕФЭщЬўЃЉЃЎ
ЃЈ1ЃЉгУCnH2n+2БэЪОЦћгЭЃЌаДГіЩЯЪіЗДгІЕФЛЏбЇЗНГЬЪН_______ЃЈашХфЦНЃЉ
ЃЈ2ЃЉШєЯђУмБеЕФКЯГЩЫўФкЭЈШыCOКЭH2ЃЌЧЁКУЭъШЋЗДгІЃЌДЫЪБЫўФкбЙЧПНЕжСЗДгІЧАЕФ![]() ЃЌЭЈЙ§МЦЫуЫЕУїЪЧЗёЩњГЩЦћгЭ______________________ЃЎ
ЃЌЭЈЙ§МЦЫуЫЕУїЪЧЗёЩњГЩЦћгЭ______________________ЃЎ
ЃЈ3ЃЉвдЬьШЛЦјЁЂНЙЬПЁЂЫЎЮЊГѕЪМдСЯЃЌПЩвджЦЕУCOКЭH2ЃЌНјЖјШЫЙЄКЯГЩЦћгЭЃЎЃЈСїГЬЪОвтЭМШчЯТЃЌЗДгІЂлЕФH2вВгЩЗДгІЂйЕУЕНЃЎЃЉ
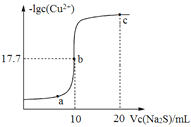
ШєЗДгІЂйЁЂЂкЁЂЂлЕФзЊЛЏТЪОљЮЊ100%ЃЌЧвНЋЗДгІЂйжаЕУЕНЕФCO2КЭH2ШЋВПгУгкКЯГЩШЫЙЄЦћгЭЃЎ
ЃЈaЃЉЭЈЙ§МЦЫуЫЕУїЩЯЪіЗНАИФмЗёЕУЕНРэЯыЕФВњЦЗ________________ЃЎ
ЃЈbЃЉЕБCO2ЕФЪЙгУСПгІПижЦЮЊЗДгІЂйжаCO2ВњСПЕФ_____ЃЈЬюБШР§ЗЖЮЇЃЉЃЌПЩвдЕУЕНРэЯыЕФВњЦЗЃЎ
ЁОД№АИЁПnCO+(2n+1)H2![]() CnH2n+2+nH2O
CnH2n+2+nH2O ![]() =
=![]() ЃЌНтЕУЃКn=3ЃЌМДЧЁКУЗДгІЩњГЩБћЭщЃЌЮоЦћгЭЩњГЩ ВЛФмЕУЕНРэЯыВњЦЗ
ЃЌНтЕУЃКn=3ЃЌМДЧЁКУЗДгІЩњГЩБћЭщЃЌЮоЦћгЭЩњГЩ ВЛФмЕУЕНРэЯыВњЦЗ ![]() ЁЋ
ЁЋ![]()
ЁОНтЮіЁП
(1)ИљОнЬтвтжЊгУCOКЭЧтЦјКЯГЩЦћгЭЕФВњЮяГ§ЬўЭтЛЙгаЫЎЃЌНсКЯжЪСПЪиКуЖЈТЩПЩаДГіЗДгІЕФЛЏбЇЗНГЬЪНЃЛ
(2)ЕБЭъШЋЗДгІКѓЃЌКЯГЩЫўФкЮТЖШВЛБфЃЌЫўФкЦјЬхбЙЧПНЕЕЭЕНдРДЕФ![]() ЃЌЫЕУїЮяжЪЕФСПБфЮЊдРДЕФ
ЃЌЫЕУїЮяжЪЕФСПБфЮЊдРДЕФ![]() ЃЌИљОнЗДгІЗНГЬЪНЗжЮіЩњГЩЮяжаЕФдзгзщГЩЃЌдйХаЖЯЃЛ
ЃЌИљОнЗДгІЗНГЬЪНЗжЮіЩњГЩЮяжаЕФдзгзщГЩЃЌдйХаЖЯЃЛ
(3)(a)ИљОнЛЏбЇЗНГЬЪНЃКnCO+(2n+1)H2 ![]() CnH2n+2+nH2OЃЌЕБn=5ЁЋ8ЪБЃЌЫЕУї
CnH2n+2+nH2OЃЌЕБn=5ЁЋ8ЪБЃЌЫЕУї![]() ЃО
ЃО ЃО
ЃО![]() ЃЌдйНсКЯCH4+2H2O
ЃЌдйНсКЯCH4+2H2O![]() CO2+4H2ЁЂCO2+C
CO2+4H2ЁЂCO2+C![]() 2COЗжЮіХаЖЯЃЛ
2COЗжЮіХаЖЯЃЛ
(b)ИљОнЗДгІCH4+2H2O ![]() CO2+4H2ЁЂCO2+C
CO2+4H2ЁЂCO2+C![]() 2COЁЂnCO+(2n+1)H2
2COЁЂnCO+(2n+1)H2 ![]() CnH2n+2+nH2OЃЌНсКЯ
CnH2n+2+nH2OЃЌНсКЯ![]() ЃО
ЃО ЃО
ЃО![]() ЗжЮіХаЖЯЁЃ
ЗжЮіХаЖЯЁЃ
(1)ИљОнжЪСПЪиКуПЩжЊЗДгІЩњГЩCnH2n+2КЭЫЎЃЌдђЗДгІЕФЗНГЬЪНЮЊnCO+(2n+1)H2 ![]() CnH2n+2+nH2OЃЌЙЪД№АИЮЊЃКnCO+(2n+1)H2
CnH2n+2+nH2OЃЌЙЪД№АИЮЊЃКnCO+(2n+1)H2 ![]() CnH2n+2+nH2OЃЛ
CnH2n+2+nH2OЃЛ
(2)ЕБЭъШЋЗДгІКѓЃЌКЯГЩЫўФкЮТЖШВЛБфЃЌЫўФкЦјЬхбЙЧПНЕЕЭЕНдРДЕФ![]() ЃЌЫЕУїЮяжЪЕФСПБфЮЊдРДЕФ
ЃЌЫЕУїЮяжЪЕФСПБфЮЊдРДЕФ![]() ЃЌИљОнЗДгІnCO+(2n+1)H2
ЃЌИљОнЗДгІnCO+(2n+1)H2 ![]() CnH2n+2+nH2OЃЌ
CnH2n+2+nH2OЃЌ![]() =
=![]() ЃЌНтЕУЃКn=3ЃЌМДЧЁКУЗДгІЩњГЩБћЭщЃЌЮоЦћгЭЩњГЩЃЌЙЪД№АИЮЊЃК
ЃЌНтЕУЃКn=3ЃЌМДЧЁКУЗДгІЩњГЩБћЭщЃЌЮоЦћгЭЩњГЩЃЌЙЪД№АИЮЊЃК![]() =
=![]() ЃЌНтЕУЃКn=3ЃЌМДЧЁКУЗДгІЩњГЩБћЭщЃЌЮоЦћгЭЩњГЩЃЛ
ЃЌНтЕУЃКn=3ЃЌМДЧЁКУЗДгІЩњГЩБћЭщЃЌЮоЦћгЭЩњГЩЃЛ
(3)(a)ИљОнЛЏбЇЗНГЬЪНЃКnCO+(2n+1)H2 ![]() CnH2n+2+nH2OЃЌЕБn=5ЁЋ8ЪБЃЌ
CnH2n+2+nH2OЃЌЕБn=5ЁЋ8ЪБЃЌ![]() ЃО
ЃО ЃО
ЃО![]() ЃЌЖјгЩCH4+2H2O
ЃЌЖјгЩCH4+2H2O![]() CO2+4H2ЁЂCO2+C
CO2+4H2ЁЂCO2+C![]() 2COжЊЃЌШєЗДгІЂйжаCO2ШЋВПгУгкКЯГЩЦћгЭЃЌдђ
2COжЊЃЌШєЗДгІЂйжаCO2ШЋВПгУгкКЯГЩЦћгЭЃЌдђ ЃН
ЃН![]() ЃО
ЃО![]() ЃЌЙЪВЛФмЕУЕНРэЯыВњЦЗЃЌЙЪД№АИЮЊЃКВЛФмЕУЕНРэЯыВњЦЗЃЛ
ЃЌЙЪВЛФмЕУЕНРэЯыВњЦЗЃЌЙЪД№АИЮЊЃКВЛФмЕУЕНРэЯыВњЦЗЃЛ
(b)ЕБn=5ЁЋ8ЪБЃЌ![]() ЃО
ЃО ЃО
ЃО![]() ЃЌИљОнЗДгІCH4+2H2O
ЃЌИљОнЗДгІCH4+2H2O ![]() CO2+4H2ЁЂCO2+C
CO2+4H2ЁЂCO2+C![]() 2COЁЂnCO+(2n+1)H2
2COЁЂnCO+(2n+1)H2 ![]() CnH2n+2+nH2OЃЌПЩжЊЃЌ1molCO2ФмЙЛЩњГЩ2molCOЃЌЫљвдЕБCO2ЕФЪЙгУСПгІПижЦЮЊЗДгІЂйжаCO2ВњСПЕФ
CnH2n+2+nH2OЃЌПЩжЊЃЌ1molCO2ФмЙЛЩњГЩ2molCOЃЌЫљвдЕБCO2ЕФЪЙгУСПгІПижЦЮЊЗДгІЂйжаCO2ВњСПЕФ![]() ЁЋ
ЁЋ![]() ЃЌПЩвдЕУЕНРэЯыЕФВњЦЗЃЌЙЪД№АИЮЊЃК
ЃЌПЩвдЕУЕНРэЯыЕФВњЦЗЃЌЙЪД№АИЮЊЃК![]() ЁЋ
ЁЋ![]() ЁЃ
ЁЃ

 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИЁОЬтФПЁПввЖўЫсЫзГЦВнЫсЃЈНсЙЙМђЪНЮЊHOOCЉCOOHЃЌПЩМђаДЮЊH2C2O4ЃЉЃЌЫќЪЧвЛжжживЊЕФЛЏЙЄдСЯЃЎЃЈГЃЮТЯТ0.01mol/LЕФH2C2O4ЁЂKHC2O4ЁЂK2C2O4ШмвКЕФpHШчБэЫљЪОЃЎЃЉ
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.1 | 3.1 | 8.1 |
ЬюПеЃК
ЃЈ1ЃЉаДГіH2C2O4ЕФЕчРыЗНГЬЪН_______ЃЎ
ЃЈ2ЃЉKHC2O4ШмвКЯдЫсадЕФдвђЪЧ_____ЃЛЯђ0.1mol/LЕФВнЫсЧтМиШмвКРяЕЮМгNaOHШмвКжСжаадЃЌДЫЪБШмвКРяИїСЃзгХЈЖШЙиЯЕе§ШЗЕФЪЧ______ЃЎ
aЃЎcЃЈK+ЃЉ=cЃЈHC2O4ЉЃЉ+cЃЈH2C2O4ЃЉ+cЃЈC2O42ЉЃЉ
bЃЎcЃЈNa+ЃЉ=cЃЈH2C2O4ЃЉ+cЃЈC2O42ЉЃЉ
cЃЎcЃЈK+ЃЉ+cЃЈNa+ЃЉ=cЃЈHC2O4ЉЃЉ+cЃЈC2O42ЉЃЉ
dЃЎcЃЈK+ЃЉЃОcЃЈNa+ЃЉ
ЃЈ3ЃЉH2C2O4гыЫсадИпУЬЫсМиШмвКЗДгІЃЌЯжЯѓЪЧгаЦјХнЃЈCO2ЃЉВњЩњЃЌзЯЩЋЯћЪЇЃЎаДГіЗДгІЕФРызгЗНГЬЪН______ЃЛгжжЊИУЗДгІПЊЪМЪБЫйТЪНЯТ§ЃЌЫцКѓДѓДѓМгПьЃЌПЩФмЕФдвђЪЧ_______ЃЎ
ЃЈ4ЃЉФГЭЌбЇЩшМЦЪЕбщШчЭМЫљЪОЃКСНИіЩеБжаЕФЪдЙмЖМЗжБ№ЪЂга2mL 0.1 mol/L H2C2O4ШмвККЭ4mL 0.1mol/L ЫсадKMnO4ШмвКЃЌЗжБ№ЛьКЯВЂеёЕДЃЌМЧТМШмвКЭЪЩЋЫљашЪБМфЃЎИУЪЕбщФПЕФЪЧбаОП________ЃЌЕЋИУЪЕбщЪМжеУЛгаПДЕНШмвКЭЪЩЋЃЌЭЦВтдвђ_______ЃЎ
ЃЈ5ЃЉвбжЊВнЫсЃЈH2C2O4ЃЉЪмШШЗжНтЕФЛЏбЇЗНГЬЪНЮЊЃКH2C2O4ЁњH2O+COЁќ+CO2ЁќЃЌаДГіFeC2O4дкУмБеШнЦїжаИпЮТЗжНтЕФЛЏбЇЗНГЬЪН________ЃЎ